オンコロの可知です。
昨年書いた「光免疫療法」の記事について、沢山の反響ありがとうございます。
光免疫療法 ~第3相試験LUZERA-301が開始、期待される治療法、臨床応用への最終段階~
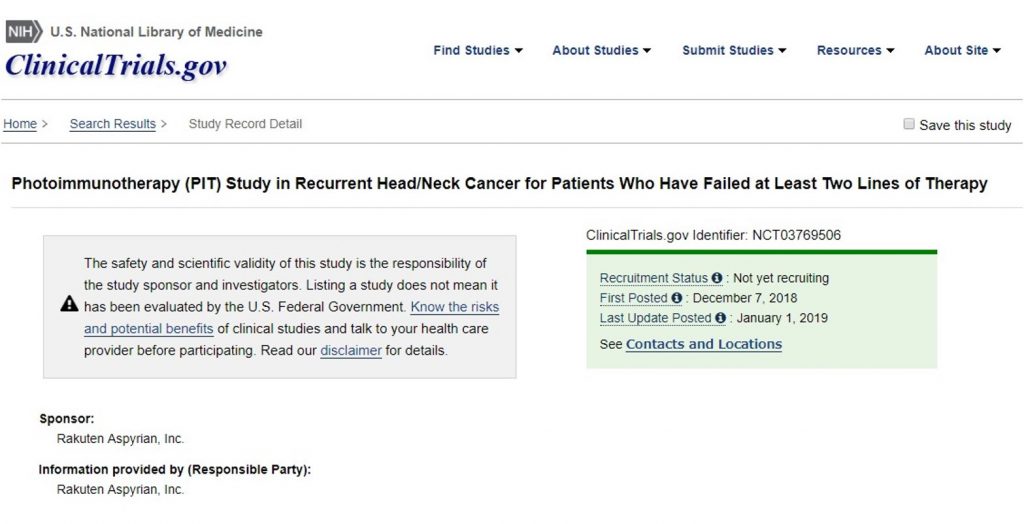
今回、LUZERA-301試験が米国の治験登録サイトClicanilal trials.govにその詳細が掲載されたため紹介します。
https://clinicaltrials.gov/ct2/show/NCT03769506
目次
光免疫療法 第3相試験、LUZERA-301
LUZERA-301試験概要
LUZERA-301試験のオフィシャルタイトルは以下の通りです。
Phase 3 Randomized, Double-Arm, Open-Label, Controlled Trial of ASP-1929 Photoimmunotherapy Versus Standard of Care for Locoregional Recurrent Head/Neck Squamous Cell Carcinoma in Patients Who Have Failed After at Least Two Lines of Therapy
日本語の正式タイトルではありませんが、訳すと「少なくとも2つの治療に不応・不耐の局所再発頭頸部扁平上皮癌患者に対するASP-1929光免疫療法と標準治療を比較する2群間非盲検無作為化比較試験」といったところでしょうか。
このタイトルからわかることは、以下の通りです。
・局所再発頭頸部扁平上皮癌のみが対象であること。
・再発頭頸部扁平上皮癌に対して2つの治療を実施したがそれらの治療ができなくなった方が対象であること。
・光免疫療法と標準療法を比較する2群間のランダム化比較試験(RCT)であること。
その他、主要評価項目は、無増悪生存期間(PFS)と全生存期間(OS)です。ざっくばらんに言うと、標準治療と比較して「光免疫療法の効果が長く続くか?」「生存に寄与を与えるか?」のどちらかが示せれば承認される可能性が高いということです。
ここでいう標準治療とは、治験担当医が選択した治療となっており、ドセタキセル、セツキシマブ(アービタックス)、メトトレキサートが想定されています。アービタックスは前回の記事でも示したとおりASP-1929の光吸収物質を運ぶ抗体でもありますね。
なお、試験開始予定日は2019年1月15日(これは米国の予定日と思われる)、登録予定数は275名とされています。
LUZERA-301の参加条件
さて、本試験の参加条件を見ていきます。
治験の場合、適格基準と除外基準から構成されていますが、それらを原文を照らし合わせてみていきます。なお、全て意訳になりますのでご注意を。
まず、対象のがん種・組織型とどのような治療を行ってきたかの条件を見ていきます。
【適格基準】
・組織学的に局所性の再発性または二次性の頭頸部扁平上皮がんを有する患者で、根治的治療を受けられない方
・頭頸部扁平上皮がんに対して2つ以上の治療を実施したが進行してしまった方。ただし、2つの治療のうち1つは、原発性または再発性の頭頸部癌の治療のための全身化学療法でなければならない。
・頭頸部扁平上皮がんの治療のために根治的放射線療法を完了している方。
・全ての局所領域の頭頸部腫瘍部位に光照射治療のためにアクセス可能であること。
【除外基準】
・現在、遠隔転移を有する方。
上記4つからわかることは、「頭頸部扁平上皮がんであること(頭頸部がんでも唾液腺がんなどの腺がんは対象になっていない)」「局所のみに再発していること(遠隔転移がある方は参加できない)」「全ての腫瘍部位に光が届けることが可能なこと」「根治治療が望めない方」「根治的放射線治療や化学療法(抗がん剤治療)を行っている方」ということになります。
もう少しひも解くと「放射線や抗がん剤など治療を試したけれど治療効果がない方、かつ、他の臓器に転移していない頭頸部扁平上皮がんの方、そして、その全ての腫瘍部位に光が届けられる手段がある方」が前提条件となり、「遠隔転移」を有しないというところに治験参加へのハードルを感じます。
次に、全員状態の状況を見ていきます。
【適格基準】
・ECOGパフォーマンスステータス(PS)が0~1の方。(PSについてはリンク辞書をみてほしいですが、感覚的には日常生活に少し支障はあるものの生活できている方)
【除外基準】
・ヘモグロビン(Hb)が9.0g/dL以下、白血球(WBC)が2000/μL以下の方、血小板(PTL)が100000/μL以下の方。
・肝機能障害のある患者。
・腎機能障害のある患者。
となり、これは他の治験と変わりはありません。ただし、前提条件から治療後期の方が対象であるのにかかわらず、PSが1以下というのはどの治験でもハードルになるところです。オンコロの問い合わせで他の条件を満たしていても、この観点から参加できなかった方を数多く知っています。
その他、以下のような基準があります。
【適格基準】
・年齢は18歳以上(もしかしたら日本では20歳以上になる可能性あり)
【除外基準】
・重大な(グレード3以上)セツキシマブ注入反応の既往がある方(セツキシマブ(アービタックス)を使用している方で、アービタックス注入後に重度のアレルギー反応が発現してしまった方)
・頭頸部扁平上皮がん以外のがんがある方(上皮内がんを除く)
他にも条件がありますが、このように誰もが参加できる治験ではないことがみて取れます。(これは、この治験に限ったことではありませんが・・・)
日本ではいつ始まる?医療機関は?
では、肝心の日本でいつ始めるのか?や医療機関はどこなのか?といった情報は、残念ながら、現状(2019年1月10日時点では)わかりません。
おそらく、国立がん研究センター東病院では実施すること、状況からみて夏ごろまでには開始するのではないかとは予想していますが、情報は仕入れていません。
今後、JAPICのような日本の治験登録サイトにも登録がなされていくはずですし、Clinilal trials.govにも医療機関情報は入力されていくはずです。そういった情報に気づいたら何らかの形で、報じたいとは思っています。
LUZERA-301試験のデザインから予想できること
最後にLUZERA-301試験の試験デザインから予想できることを少し述べます。これは私見です。
まず、オンコロが光免疫療法について昨年末まで報じなかった理由に「本当に転移巣にも効果があるか?」といった疑問がありました。光療法として光量が届いた部位に対しての効果は間違いなさそうであるけれど、免疫療法としてのパフォーマンスは全くもって不透明だなと思っていたところにあります。
ここでLUZERA-301試験は多臓器に転移がある患者さんを除外としました。
治験はより勝算の高いカタチで計画され、LUZERA-301試験は多臓器に転移の方を除外にした。このことからも、転移巣に対するパフォーマンスは勝算が高い段階ではないことが予想されます。
ある腫瘍免疫学の著名な先生が「ペプチドワクチンにせよ、養子免疫療法にせよ、がん免疫はマウスに対してはよく効くのが多いんだよね。ほんとに消えちゃうのも多い。でも、期待して臨床試験やってみるとヒトには効かないを繰り返してきた。光免疫療法もマウスには効くのはわかるけど、ヒト(の転移巣)で効くかわかんないんだよね。」と言っていました。(許可取っていないので名前は伏せます)
期待はしつつ、それでも冷静に情報を捉えていっていただければ幸いです。(特に便乗すると予想される悪徳クリニックにはご注意を)
(文:可知 健太)
この記事は2019年1月10日現在の情報をもとにまとめています。