京都大学 本庶佑氏の研究グループは、プログラム細胞死受容体1(PD-1)の働きを阻害するニボルマブ(オプジーボ)など、PD-1抗体の有効性を増強する併用療法を見いだした。マウスモデルを用い、T細胞のミトコンドリア活性を促進する低分子化合物を併用することにより、PD-1抗体の抗腫瘍効果が増強するという概念実証(Proof-of-Concept[POC])に成功した。研究結果が2017年1月の米国科学アカデミー紀要(PNAS)に掲載された。
本庶佑氏の研究グループがPD-1という分子を発見したことで免疫チェックポイント阻害薬の開発が始まり、PD-1抗体オプジーボなどの新薬登場でがん薬物療法に革新をもたらした。奏効率が劇的に向上した。悪性黒色腫の一次療法では1年後の全生存率が70%を超えたという報告もある。しかし、PD-1阻害療法に反応しない、あるいは反応性が低い患者、いわゆる非レスポンダーはおよそ30%から50%存在するのが現実である。本庶氏らは、非レスポンダーを如何にしてレスポンダーにするか、を重要課題として併用療法の研究を行ってきた。
研究の主な成果は次のとおり。
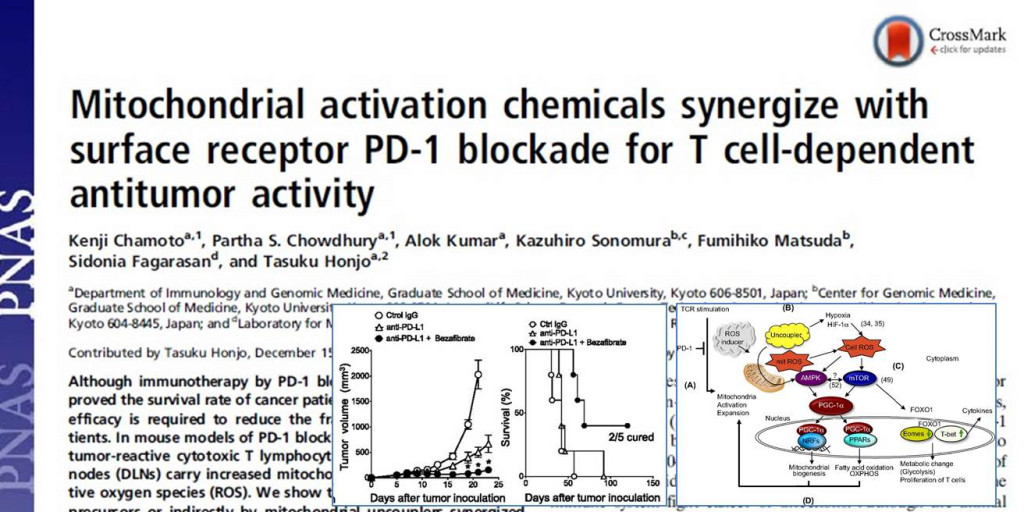
・脂質異常症(高脂血症)治療薬として承認されているベザフィブラートが、PD-1抗体の抗腫瘍効果を増強した。
・ミトコンドリア活性を示す分子がPD-1抗体の有効性を予測するバイオマーカーとなる可能性がある。
・キラーT細胞のミトコンドリアを活性化するとがんを攻撃するT細胞のエネルギーが増加した。
・がんの進行に伴い、がん反応性キラーT細胞(TR CTL)は所属する流入領域リンパ節(DLN)で増殖してがん局所に移行するため、がん局所とともにリンパ節を外科的切除することは、抗腫瘍効果に重要な役割を果たすTR CTLをも除去してしまうことになる。
・ミトコンドリアを活性化するカギとなる分子は、ペルオキシソーム増殖因子活性化受容体-ガンマ(PPARγ)の共役因子であるPGC-1αと判明した。
目次
PD-1阻害抗体による抗腫瘍効果に必要な条件
大腸がん細胞株(MC38)を移植したマウスモデルで、細胞傷害性T細胞(CTL)の刺激、および産生には流入領域リンパ節(DLN)が必要で、さらに、CTLが効率的な殺腫瘍活性を発揮するために、CTLは、ケモカインMIG(CXCL9)とケモカイン受容体CXCR3のシグナルに依存する経路で腫瘍局所に輸送されることが明確に示された。PD-1を阻害すると、DLN内のがん反応性CD8陽性T細胞のミトコンドリア活性が亢進した。
ミトコンドリア活性化のメカニズム
活性酸素種(ROS)を発生させる化合物をPD-1阻害抗体と併用投与した結果、PD-1阻害抗体の単独投与と比べ抗腫瘍効果が増大した。その際発生したROSは、T細胞のエネルギーを調節する機構的ラパマイシン標的蛋白質(mTOR)をエフェクターT細胞で、AMP活性化プロテインキナーゼ(AMPK)をメモリーT細胞で活性化し、同時に、mTORとAMPKの経路下流に共通して存在するPPARγ共役因子PGC-1αを活性化した。
PD-1阻害抗体はがんの免疫監視状態を緩め、免疫細胞を活性化させてがん細胞を認識、攻撃させるように働く。免疫細胞が活性化する際には当然エネルギーが必要となる。エネルギー産生の場として機能する細胞質小器官のミトコンドリアを活性化すれば、エネルギー供給量は増える。その標的分子がPGC-1αであることが突き止められた。ということは、PGC-1αを活性化する低分子化合物がPD-1阻害抗体の併用パートナー候補であり、しかも、すでに広く使用され、安全性も検証済みのベザフィブラートがキラーT細胞のミトコンドリアが産生するエネルギー量を増加させることも実証された。
ベザフィブラートは中性脂肪を低下させる脂質異常症治療薬
ベザフィブラートは、中性脂肪の合成を阻害すると同時に分解も促進し、結果として中性脂肪を低下させる。ベザフィブラートは、リポ蛋白リパーゼを活性化することで中性脂肪をグリセリンと脂肪酸に分解し、その際に産生、増加する脂肪酸がミトコンドリアのクエン酸回路(TCA回路)でエネルギーを産生させる。ミトコンドリアは活発に働く。
併用療法の確立によりPD-1阻害抗体の投与量減量の可能性も考えられる。減量は医療費削減にもつながる。
注:基礎研究段階の文献を紹介しています。併用時の臨床的効果や安全性は明らかになっていません。個々人の判断にて併用することは決してしないでください。
記事:可知 健太