目次
非小細胞肺がん タグリッソ承認の根拠となった第2相試験 Lancet Oncol
EGFR T790M遺伝子変異陽性に対する直接標的薬のデータとして初公表
2016年3月、上皮増殖因子受容体(EGFR)T790Mチロシンキナーゼの不可逆的阻害薬オシメルチニブ(商品名タグリッソ)が厚労省による製造販売承認を取得した。適応症は、EGFRチロシンキナーゼ阻害薬に抵抗性のEGFR T790M遺伝子変異陽性で手術不能、または再発の非小細胞肺がん(NSCLC)で、EGFR T790M遺伝子変異に特化した直接標的薬である。
承認取得の根拠となったのは2本の第2相試験(AURA延長試験、AURA2試験)で、カナダOttawa大学がんセンターのGlenwood Goss氏らは、AURA2試験(NCT02094261、JapicCTI-142551)の中間解析結果を2016年10月14日のLancet Oncol Onlineに発表した。
タグリッソを使用する群のみ臨床試験
AURA2は2014年5月、カナダ、米国、欧州、日本、韓国、台湾、香港などおよそ40施設で開始された単群非盲検試験で、EGFRチロシンキナーゼ阻害薬の前治療で進行した、EGFR T790M遺伝子変異陽性で局所進行、もしくは転移性のステージIIIBまたはステージIV非小細胞肺がん(NSCLC)を対象とし、タグリッソ錠剤を用いて1日80mgを連日経口投与した。無症候性でステロイド不要の安定状態の中枢神経系転移患者も登録可能とした。主要評価項目は奏効率であった。
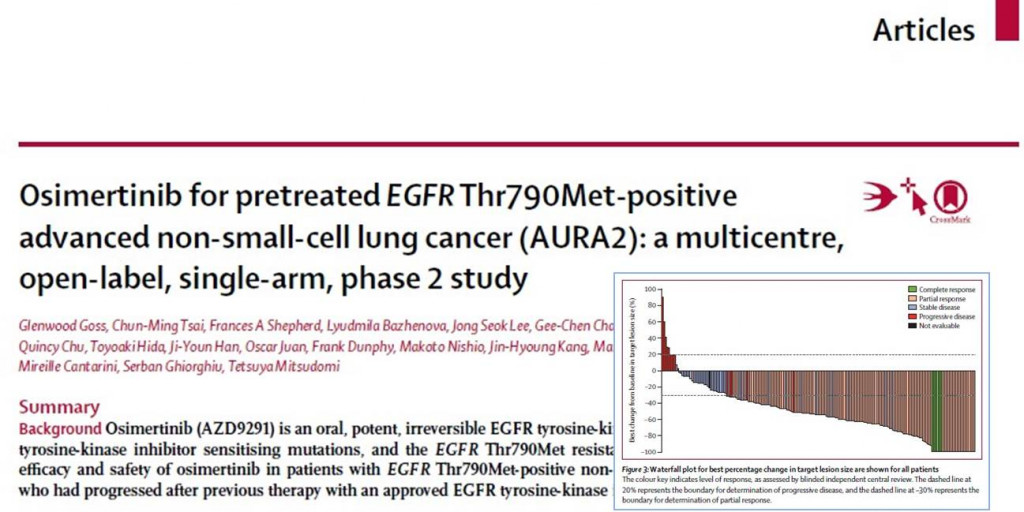
2013年6月13日から2014年10月27日までに210人に投与され、有効性解析対象は199人、データカットオフ時点(2015年11月1日)で、122人(58%)が治療継続中であった。
奏効率70% 完全奏効率3%
追跡期間中央値は13.0カ月で、第三者機関盲検判定の奏効率は70%(140/199人)で、そのうち完全奏効(CR)が6人(3%)、部分奏効(PR)が134人(67%)であった。6週間以上持続する病勢安定(SD)の42人(21%)を含めると、病勢コントロール率は92%(182/199人)に達した。奏効140人のうち、データカットオフ時点で半数(50%)が生存し、奏効持続期間中央値は11.4カ月であった。
無増悪生存(PFS)期間中央値は9.9カ月で、カプラン-マイヤー曲線に基づく治療6カ月後の無増悪生存率は71%、9カ月後では56%、12カ月後では44%と算出された。
奏効率の層別解析で、前治療の数、人種(アジア、非アジア)、性別、年齢、直近に受けたEGFRチロシンキナーゼ阻害薬の投与期間と、直近治療後からタグリッソ投与開始までの期間、中枢神経系転移の有無、喫煙歴などによる差は認められず、いずれも67%から73%の範囲内に収まっていた。
有意差はなかったものの、試験開始時の腫瘍生検標本を用いた遺伝子解析で、EGFRのT790変異と同時にEGFRのエクソン19欠失変異が存在していた患者集団の奏効率(77%[99/129人])は、同時にEGFRのL858A点変異が存在していた患者集団(59%[37/63])より高かった。これはエビデンスとして報告されてはいるが、本試験ではエクソン19欠失変異の患者数がL858A点変異の患者数の2倍以上多かったことから、一定したデータの捉え方をするのが困難であった。
グレード3以上の有害事象は12%
因果関係の否定できないグレード3の有害事象は26人(12%)に発現し、主に心電図QT延長(4人[2%])、好中球数減少(3人[1%])、発疹(2人[1%])などで、グレード4は発現しなかった。因果関係の否定できない重篤な有害事象は11人(5%)に発現し、そのうちグレード5の間質性肺疾患(1人)のみが死亡した。
EGFR T790M遺伝子変異に直接作用することとバイオマーカーの意義
EGFRチロシンキナーゼ阻害薬に抵抗性を示す非小細胞肺がん(NSCLC)患者の48%から62%はEGFR T790M遺伝子変異陽性である。これまで、EGFRチロシンキナーゼ阻害薬の治療に失敗した患者の二次治療は限定的で、プラチナ製剤の2剤併用療法や単剤化学療法で有効性を得られる患者は少なかった。しかも、EGFRチロシンキナーゼ阻害薬とプラチナ2剤化学療法の双方に失敗した場合、以降の治療についてのグローバルスタンダードが存在しなかったため、そうした患者は単剤化学療法か、EGFRチロシンキナーゼ阻害薬に再挑戦するか、あるいは開発段階の薬剤の臨床試験に参加する選択肢しかなかった。
本試験におけるタグリッソの有効性は、EGFRチロシンキナーゼ阻害薬の治療に失敗した患者を対象に実施されてきた標準治療と比べ大幅に向上した。例えば、化学療法2剤併用のシスプラチン+ペメトレキセドは奏効率39%、無増悪生存(PFS)期間5.3カ月、EGFRチロシンキナーゼ阻害薬アファチニブと化学療法単剤の併用はそれぞれ32%、5.6カ月だ。化学療法単剤のみでは成績はさらに低下し、それぞれ13%、2.8カ月。
本試験を踏まえると、第1世代、または第2世代のEGFRチロシンキナーゼ阻害薬の治療で病勢進行(PD)した時点で、腫瘍生検標本を採取することが重要だということが言える。EGFR T790Mのバイオマーカー評価を行うためで、分子標的薬を選択する根拠となるからである。
タグリッソは日米欧で迅速承認
米国食品医薬品局(FDA)はタグリッソを画期的治療薬に指定し、欧州医薬品評価委員会(CHMP)も迅速審査指定で、いずれも短期間で承認された。日本では2015年8月に申請後、優先審査品目に指定され、およそ7カ月で承認された。
現在、プラチナ2剤併用化学療法の標準治療を対照とする第3相試験(AURA3、NCT02151981、 JapicCTI-142652)が患者登録を完了し、結果待ちの段階にある。
記事:川又 総江