講演タイトル:『がんの臨床試験(治験)』
演 者:兵頭 一之介 先生(筑波大学医学医療系臨床医学域 消化器内科)
日 時:12月26日(木)
場 所:日本橋ライフサイエンスハブ8F D会議室
第48回ONCOLO Meets Cancer Experts(OMCE)は、「がんの臨床試験(治験)」をテーマに、筑波大学医学医療系臨床医学域 消化器内科の兵頭 一之介先生にご講演いただきました。
クローズドセミナーであるため全ての情報は掲載できませんが、ポイントとなる情報をお伝えしていきます。
目次
臨床試験の倫理と規制
まず、兵頭先生は学生に教えている医療倫理の原則として、紀元前4世紀の「ヒポクラテスの誓い」を紹介。ヒポクラテスは「医学の父」とも呼ばれる古代ギリシャの医師です。その時代から原則的なことは全く変わっておらず、「恩恵原則」「無加害原則」を基本として、「明確に患者に害を出してはいけないということがうたわれています」と語りました。
一方、人を対象とした試験の歴史として、ドイツ・ナチスや旧日本軍・731部隊による人体実験に触れ、「世界では『世界人権宣言』等で医学の科学的な倫理性が定められ、我が国では憲法の第3章、基本的人権の『享有で永久の権利』として保証される、あるいは生命・自由・幸福を追求する権利があり、国民は個人として尊重されています」と、このような過ちを繰り返さないことが社会通念として、全世界的に共有されていることが示されました。
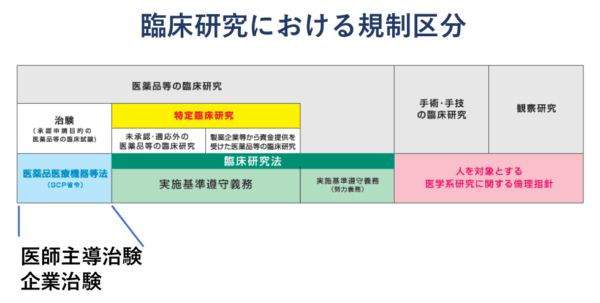
また、実際の臨床研究における規制としては、国際的なガイドラインである「ICHガイドライン」、国内の「GCP省令」、2018年4月1日に施行された「臨床研究法」のほか、「人を対象とする医学系研究に関する倫理指針」が定められています。
臨床試験(治験)の実際
次に、「臨床試験の実際」の章では、候補化合物の発見から上市(承認を受け、発売すること)までの難しさを説明。治験の前、薬剤の候補物質の発見から非臨床の試験について、「昔は(候補となる物質を)自然界から取ってきていたので、非常に長い期間かかっていましたが、最近はコンピューターで構造式を決めて、最適な阻害効果を得られる化合物をあっという間に作るというような時代になってきています」と、以前よりも早期開発に期待がもてるようになっているものの、「安全性のデータはきちんと取らなければならず、やはり早くても数年はかかります」と語りました。
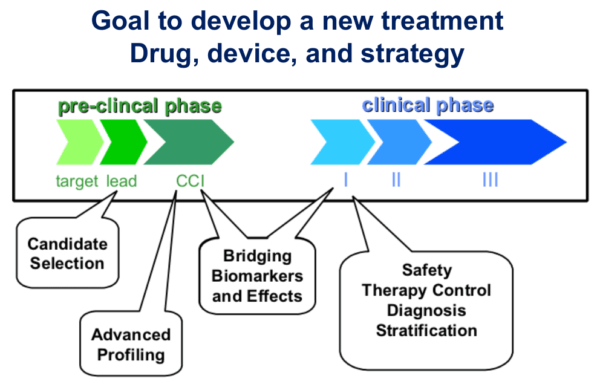
その後、薬の開発は人への投与が行われる「クリニカルフェーズ(臨床段階)」へ移りますが、3段階ある臨床試験のうち、最終段階である第3相試験を経て薬剤として承認されるまでは「平均で8~9年くらいかかってくるのが現実」とのこと。これほどの長期間をかけても、いかほどの薬剤開発の成功率であるのかいうと、「抗がん剤では、約7%の成功率。(ほかの疾患と比べて)がんの薬剤開発の成功率が低いという訳ではないと思います」と兵頭先生は語りました。それでも1割にも満たないことから、「やはり薬剤の開発成功率は低い」としています。
また、臨床開発の過程について、第1相試験では「毒性」、第2相試験では「腫瘍縮小」、第3相では「生存期間」というそれぞれの試験での目標(エンドポイント)を紹介したうえで、第2相試験の目標である腫瘍縮小に関して、兵頭先生は次のように語りました。
「腫瘍が縮小していると患者さんはうれしいですよね? 治療提供者側もそうです。生存を延長するためには、まず腫瘍の縮小がなければなりませんが、そういう意味でも腫瘍を縮小するということは非常に大きなことです」(兵頭先生)
さらに治療薬開発の最終段階である第3相試験については、基本的に「生存期間を延ばすこと」(overall survival:OS)か、「その薬剤で治療している期間を延ばすこと」(progression free survival:PFS)を目標とし、他の治療法と比べて優越かどうかを調べる「優越性試験」、劣っていないかを調べる「非劣性試験」が行われることを、具体的な試験結果を挙げながら紹介してくださいました。
バイオマーカーの重要性
兵頭先生によるご講演、最後の章は「バイオマーカーの重要性」について。現在、がん治療薬の開発では「バイオマーカー」が重要と指摘し、大腸がんや胃がん、乳がんなどで発現が認められるEGFR (HER)ファミリーの変異を例に解説してくださいました。
「大腸がんではEGFRの遺伝子変異が高発現することがあります。乳がんや胃がんの一部でもこのうちHER2と呼ばれることが多いEGFR2の変異が高発現しています」(兵頭先生)
一方、大腸がんの半数ではRASと呼ばれる遺伝子が変異を起こしており、これはがん細胞の増殖を促すシグナルを自律的に促す「アクセル」となることを紹介。RASの遺伝子変異があるとEGFR阻害薬という種類のお薬が効きにくいことが知られているため、兵頭先生は「大腸がん患者さんではまずこのRASに変異があるかどうかを調べましょう、ということになっています」と、RASの変異が治療法を選択するうえで欠かせない「マーカー」であることを示しました。
このほか、現在各社で開発が盛んにおこなわれているADC(抗体-薬物複合体)の仕組み、第2相試験で有望な結果が出ていた薬物が第3相試験の「デザイン」(目標の定め方)の問題によって、残念ながら承認へと進めなかった例などを紹介。また、各種バイオマーカーの発見ががんの「診療ガイドライン」へ与える影響、複数の遺伝子変異を同時に調べることができるコンパニオン診断システムへの期待などを解説し、「バイオマーカーが小分子化合薬や免疫チェックポイント阻害薬による治療を選択するうえで、非常に重要な役割を果たしており、今後もその流れは変わらないでしょう」と語りました。
質疑応答・感想
ここからは、当日会場で行われた質疑応答の一部を抜粋してご紹介いたします。
<質疑応答>
Q.今後の抗がん剤開発の方向性について、これまで薬剤の開発が中心でしたが、今後は医療機器と抗がん剤の組み合わせVS抗がん剤のような治験は増えていくと思われますか?
A.増えてくると思います。あくまでも集学的な治療の一環としてということです。放射線による対外的な治療にも限界があるためです。一方で、抗体に放射性物質つけて患部に送るような、薬剤としての放射線療法にはまだまだ期待が持てるのではないかと考えていますし、一部の薬剤ではすでに承認されています。
Q.医師主導治験について、希少疾患や金銭的なメリットが少ない試験は医師主導治験として実施することがあるというお話しでしたが、先生から見た医師主導試験のメリットやデメリット、課題などがあれば教えてください。
A.医師としては、やはり困っている患者さんのご相談にこたえたいと、そう思っています。希少疾患を多く紹介されるような基幹病院の先生方はみんなそう思っています。
保険の縛りが厳しくない時代は、医師の裁量として試行錯誤を行うことが可能でした。一方で、きちんとした臨床試験の体を成していないような試験もあり、それではあまりに野放し状態で科学的ではないでしょう、ということで法規制が行われました。
そこで初めて、医師側から「こうしたい」という要望がある時には、医師主導治験を行うことになったのですが、最近では臨床研究法の成立によって、他の方法でも行えるようになりました。
ただし、医師主導治験の結果は、薬剤の承認申請に活用できますが、臨床研究法のもとで行われた試験の結果は、承認申請には使えません。そこが一番の問題です。
仮に、試験で良い結果が出ても、先進医療や患者申出医療という形でしか、その治療を提供できない。保険適応を受けるためには、改めて医師主導治験や企業治験を行う必要があり、二度手間であるという点は、改善する余地があります。
Q.がん遺伝子パネル検査ではいろんな遺伝子の変異が分かりますが、その過程で遺伝性のがんのリスクが見つかってしまうなどの問題は起こらないのでしょうか?
A.結果として、遺伝性腫瘍の遺伝子異常が見つかることはあります。しかし、「Foundation One」等の検査では、「がん細胞」のチェックを行いますので、ほかの正常細胞にも異常があるかどうかはわからないため、正常細胞のチェックが必要になります。
その際には、人権に配慮した遺伝子カウンセリングが必要ですので、がんゲノム医療中核拠点病院やがんゲノム医療連携病院など、体制の整った施設でチェックを行うことになります。
<感想>
当日、会場に足を運んでくださった参加者の皆さんからは、「今話題になっている新薬やゲノムプロファイリング検査の実際について知ることができてよかった」「臨床試験のデザイン、特に統計の設定によっては効いているのに有意差が出せないことがあることがわかってよかった」など、治験やゲノム検査に関する専門的な知識を得られたことを喜ぶ声が聞かれました。
・・・・・・・・・・・・・・・・・・・・・
近年、オンコロジー領域の新薬開発は、その対象となるがん種、そして遺伝子変異のターゲットは以前にも増して狭まっており、医療従事者の方であっても最新の情報を追い続けることが難しくなっています。にもかかわらず兵頭先生のご講演では、基礎的な情報から統計学的な問題点まで幅広く、そしてわかりやすくご解説いただき、オンコロスタッフとしても大変学びの多い時間でした。
改めまして、兵頭先生、ご参加くださった皆さん、本当にありがとうございました。
<関連リンク>
がん医療セミナー ONCOLO Meets Cancer Experts(OMCE)2020 のお申込みはこちら
2020年OMCEセミナースケジュール/お申込み


