・本報告では、再発難治性または新規多発性骨髄腫(MM)患者に対して抗PD-1抗体薬であるキイトルーダを投与し、その結果免疫関連副作用(irAE)を発症した患者と発症しなかった患者における客観的奏効率(ORR)の関係性を検証している
・1つ目の報告では、免疫関連副作用(irAE)を発症した患者群における客観的奏効率(ORR)はキイトルーダ投与群37%に対してキイトルーダ非投与群49%、グレード3以上の免疫関連副作用(irAE)を発症した患者群においてはキイトルーダ投与群29%に対してキイトルーダ非投与群50%であった
・2つ目の報告では、免疫関連副作用(irAE)を発症した患者群における客観的奏効率(ORR)はキイトルーダ併用群73%に対してキイトルーダ非併用群73%、グレード3以上の免疫関連副作用(irAE)を発症した患者群においてはキイトルーダ併用群70%に対してキイトルーダ非併用群67%であった
2018年6月1日より5日までアメリカ合衆国・イリノイ州・シカゴで開催された米国臨床腫瘍学会(ASCO 2018)にて、再発難治性または新規多発性骨髄腫(MM)患者に対する抗PD-1抗体薬であるペムブロリズマブ(商品名キイトルーダ;以下キイトルーダ)の有効性を検証した2つの臨床試験であるKEYNOTE183試験(NCT02576977)、KEYNOTE185試験(NCT02579863)において免疫関連副作用(irAE)とキイトルーダの客観的奏効率(ORR)の関係性について検証した報告がUS Food and Drug Administration・Aviva C Krauss氏らにより公表された。
なお、KEYNOTE183試験、KEYNOTE185試験の両試験はキイトルーダが投与された患者の全生存率(OS)が悪化したため、2017年6月より試験の早期中止を米国食品医薬品局(FDA)より勧告されている。
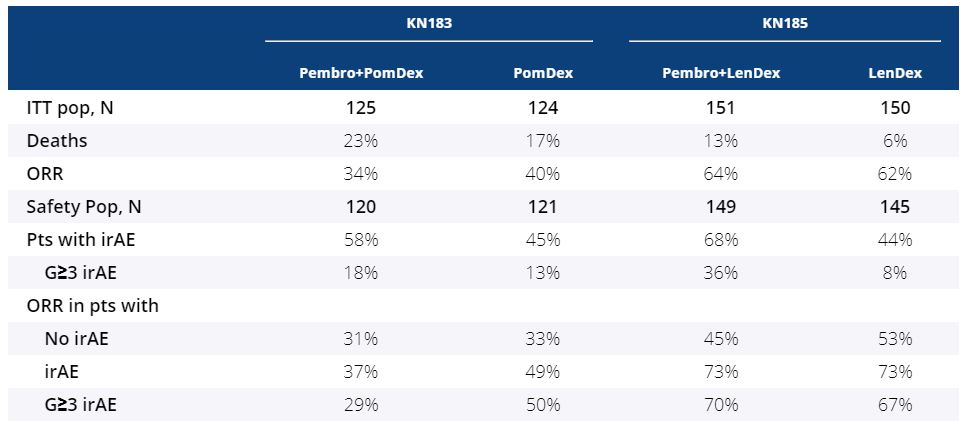
1つ目の臨床試験であるKEYNOTE183試験とは、再発難治性多発性骨髄腫患者(N=249人)に対してキイトルーダ+ポマリドミド(商品名ポマリスト;以下ポマリスト)+デキサメタゾン併用療法(N=125人)を投与する群、またはポマリスト+デキサメタゾン併用療法を投与する群(N=124人)に無作為に振り分け、主要評価項目として無増悪生存期間(PFS)、全生存期間(OS)を比較検証した第III相試験である。
KEYNOTE183試験のフォローアップ期間中央値8.1ヶ月時点における結果は下記の通りである。全グレードの免疫関連副作用(irAE)発症率はキイトルーダ併用群58%に対してキイトルーダ非併用群45%、グレード3以上の免疫関連副作用(irAE)発症率はキイトルーダ併用群18%に対してキイトルーダ非併用群13%であった。
そして免疫関連副作用(irAE)発症率別の客観的奏効率(ORR)は、免疫関連副作用(irAE)を発症しなかった患者群においてはキイトルーダ併用群31%に対してキイトルーダ非併用群33%、免疫関連副作用(irAE)を発症した患者群においてはキイトルーダ併用群37%に対してキイトルーダ非併用群49%、グレード3以上の免疫関連副作用(irAE)を発症した患者群においてはキイトルーダ併用群29%に対してキイトルーダ非併用群50%。以上のように、免疫関連副作用(irAE)とキイトルーダの客観的奏効率(ORR)に統計学的有意な関係性はなかった。
2つ目の臨床試験であるKEYNOTE185とは、新規多発性骨髄腫患者(N=301人)に対してキイトルーダ+レナリドミド(商品名レブラミド;以下レブラミド)+デキサメタゾン併用療法を投与する群(N=151人)、またはレブラミド+デキサメタゾン併用療法を投与する群(N=150人)に無作為に振り分け、主要評価項目として無増悪生存期間(PFS)、副次評価項目として全生存期間(OS)を比較検証した第III相試験である。
KEYNOTE185試験のフォローアップ期間中央値6.6ヶ月時点における結果は下記の通りである。全グレードの免疫関連副作用(irAE)発症率はキイトルーダ併用群68%に対してキイトルーダ非併用群44%、グレード3以上の免疫関連副作用(irAE)発症率はキイトルーダ併用群36%に対してキイトルーダ非併用群8%であった。
そして、免疫関連副作用(irAE)発症率別の客観的奏効率(ORR)は、免疫関連副作用(irAE)を発症しなかった患者群においてはキイトルーダ併用群45%に対してキイトルーダ非併用群53%、免疫関連副作用(irAE)を発症した患者群においてはキイトルーダ併用群73%に対してキイトルーダ非併用群73%、グレード3以上の免疫関連副作用(irAE)を発症した患者群においてはキイトルーダ併用群70%に対してキイトルーダ非併用群67%。
KEYNOTE183試験では免疫関連副作用(irAE)を発症した患者における客観的奏効率(ORR)はキイトルーダ群で良好な傾向が確認された。
結果は下図参照。
※Abstract No.8008より引用
以上の報告結果よりAviva C Krauss氏らは以下のように結論を述べている。”再発難治性または新規多発性骨髄腫患者に対する抗PD-1抗体薬であるキイトルーダの使用は全生存期間(OS)の結果同様に十分な奏効率(RR)を得る可能性は明らかではありませんので両試験ともに今後も経過観察が必要です。”
この記事に利益相反はありません。


