※本記事はEvaluate社の許可のもと、オンコロが翻訳したものです。内容および解釈については英語の原文を優先します。正確な内容については原文をお読みください。
中国Junshi社/米コヒーラス社の薬剤は化学療法に勝利しただけであり、その臨床試験は米国ではなく中国で行われた。
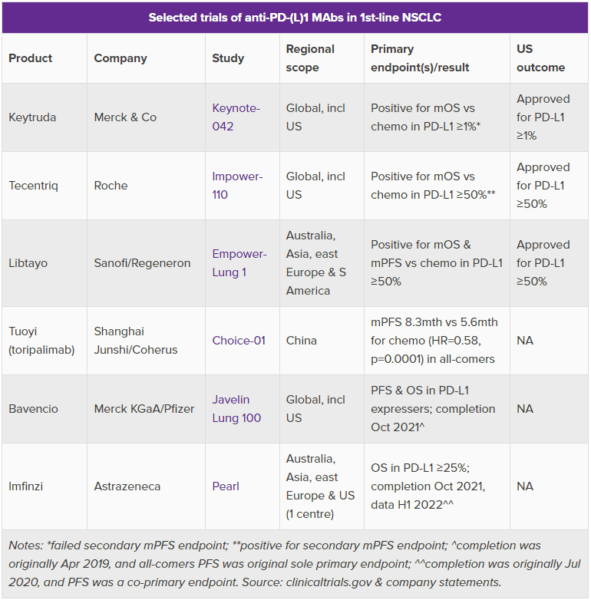
昨日(8月19日)、Shanghai Junshi社とコヒーラス社が抗PD-1抗体toripalimab(トリパリマブ)の肺がんの一次治療における成功を祝ったが、重要な問題を提起している。すなわち、FDA(米国食品医薬品局)は、すべてが中国内で実施された試験に基づいて医薬品を承認するのかということだ。
問題となっているtoripalimabのChoice-01試験は、中国のたった1つの病院で実施された。この問題は、中国と米国の患者が異なる特徴を示す可能性があるだけでなく、Choice-01試験では米国における主要な標準治療である米メルク社のキイトルーダ(一般名:ペムブロリズマブ)を対照群に使用しなかったことも関連している。その答えはtoripalimabの別の承認申請からすぐに得られるかもしれないが、コヒーラス社の低コスト戦略を考えると、政治的な側面を持つことは間違いないだろう。
米国では、toripalimabができるだけ早く承認されることを期待する声もあるだろう。コヒーラス社は、「費用対効果の高い医薬品を発売し、大幅なコスト削減を実現する」というミッションを掲げている企業だ。この考えは、米国で承認された抗PD-(L)1薬の数が7つになった免疫腫瘍学分野には特に適している。
米国で承認されるのか?
clinicaltrials.govによると、Choice-01試験は中国の単一施設である北京のCancer Hospital Chinese Academy of Medical Sciencesで実施されてはいるものの、米国で認められる試験であるかどうかは全く不明だ。
toripalimabは主要評価項目を達成し、無増悪生存期間(PFS)の中央値を化学療法の5.6カ月に対して8.3カ月に延長し、全症例における進行のリスクを41%減少させるという高い統計学的有意性を示した。しかし、キイトルーダがまだ第一選択薬として確立されていない中国においては、化学療法が適切な比較対象であるとしても、米国ではそうはいかない。
実際、対照群の被験者にキイトルーダを投与しない試験を米国で実施することは、倫理的に非常に困難であり、この事実は、他の国でそのような試験を実施することを正当化するという意見もある。しかし、Choice-01試験は、米国における患者の現実を反映していないように見える。
コヒーラス社の従業員は今後、前例を探すことになるだろう。ひとつは、仏サノフィ社/米リジェネロン社の後発のLibtayo(一般名:セミプリマブ)で、これは主にアジア、東欧、南米で実施された試験の結果、PD-L1発現率50%以上の非小細胞肺がん(NSCLC)の一次治療薬として今年米国で承認を取得した。
そして今月(8月)初め、米ビヨンドスプリング社は、米国とアジアにおける患者の薬物動態データが類似していれば、米国での被検者が20%にとどまる試験に基づいて米国で承認申請を行うことを、FDAは受け入れると主張した。
これにより、英アストラゼネカ社のイミフィンジ(一般名:デュルバルマブ)と独メルク社/米ファイザー社のバベンチオ(一般名:アベルマブ)という転移性NSCLCを対象とした2つの後発組の薬剤がどうなるのかは別の問題だ。両者とも、米国で実施されている一次治療のNSCLCを対象とした重要な試験に参加しているが、試験デザインは大幅に見直され、規模も拡大され、延期されている。おそらく、キイトルーダの使用が増加していることによる影響と考えられるが、いずれにしても成功の可能性は低いと思われる。
中国ではすでに「Tuoyi」として承認されているtoripalimabは、アジアで実施されたPolaris-02試験およびJupiter-02試験の結果に基づいた鼻咽頭がんを対象とする生物学的製剤承認申請書(BLA)を米国の規制当局が審査することで、それ自体がFDAの考え方を知る上での大きなヒントとなるだろう。
その前に、上り調子のコヒーラス社はChoice-01試験のデータの質の高さを指摘するだろう。Choice-01試験では、患者のPD-L1発現にかかわらず、toripalimabを支持しているようだ。米国において、キイトルーダはPD-L1発現率が1%以上の患者に対する単剤療法として承認されており、(PD-L1発現の有無を問わず)すべての患者では化学療法との併用療法の一部として承認されているが、一次治療におけるもうひとつの単剤療法であるスイス・ロシュ社のテセントリク(一般名:アテゾリズマブ)は、PD-L1発現率が50%以上と規定されている。
そのため、toripalimabのもうひとつの問題は、PD-L1陰性の被験者でどのような結果が得られたのかということだ。これは、全症例での効果が単にPD-L1陽性の患者によってもたらされたものである可能性があるためだ。投資家が待つ時間は長くない。Choice-01試験のデータは、来月(9月)開催されるWorld Lung Conferenceで詳細が発表される予定だ。
■出典
Tori’s lung cancer hit raises a key question