10月7日から10月11日までデンマーク コペンハーゲンにて第40回欧州臨床腫瘍学会が開催。10月9日、プレジデンシャル シンポジウム2にて、進行非小細胞肺がんの初回治療に関するニボルマブ(オプジーボ)及びペムブロリズマブ(キイトルーダ)の2つ臨床試験結果が発表された。
両薬剤は、免疫細胞が腫瘍細胞を攻撃する際にそれを制御する働きに関与するPD-1/PD-L1経路を阻害するPD-1抗体である。FDA(米国)は、非小細胞肺がん2次治療以降の使用として、昨年10月2日にキイトルーダを、10月9日オプジーボを承認した。日本では12月17日にオプジーボが承認、キイトルーダも承認申請はされており、早ければ今年中にも承認される可能性がある。
非小細胞肺がん 米国FDA PD-1抗体ペムブロリズマブ(キイトルーダ)承認(オンコロニュース20151004)
非小細胞肺がん オプジーボがキイトルーダに7日遅れでFDA承認(オンコロニュース20151009)
切除不能な進行・再発非小細胞肺がん 免疫チェックポイント阻害薬オプジーボ 承認(オンコロニュース20151217)
目次
明暗を分ける結果、キイトルーダ、PD-L1高発現非小細胞がん初回治療にて、50%のリスク軽減
非小細胞肺がんの初回治療として、標準療法である「プラチナ製剤併用療法(化学療法群)」と「キイトルーダ単剤療法(キイトルーダ群)」を比較した第3相臨床試験(Keynote024試験)。患者は腫瘍細胞にPD-L1という分子が多く発現した方(PD-L1発現50%以上。以下、PD-L1高発現)に限定され、PD-L1高発現の非小細胞肺がん患者の割合は27~30%であった。なお、EGFR遺伝子変異やALK遺伝子変異が確認された患者は除外された。
Keynote24試験には日本を含む16か国にて305名の患者が登録され、1対1の割合で「化学療法群」と「キイトルーダ群」に割り付けられた。また、「化学療法群」に割り付けられた患者は、二次治療にてキイトルーダを選択することが可能であり、44%の被験者が2次治療にキイトルーダを選択した(「化学療法群」の44%が、初回治療が化学療法→2次治療をキイトルーダ。このことをクロスオーバーという)。
主な結果については以下の通り。
・病態進行までの期間である無増悪生存期間(PFS)中央値は、「化学療法群」6.0か月に対して「キイトルーダ群」10.3か月と病態進行リスクを50%軽減した(HR:0.50, 95% Cl:0.37-0.66,p<0.001)。
・全生存期間(OS)は、両群とも中間解析時点で50%まで達していないが、投与開始から6.0か月時点において、「キイトルーダ群」の80%が生存しており、「化学療法群」は72%が生存している(HR:0.60, 95% Cl:0.41-0.69,p<0.006)。
・奏効率(腫瘍が一定以上縮小した割合)は、「化学療法群」28%に比べ「キイトルーダ群」40%であった。
・「化学療法群」の90%に副作用(治療関連有害事象)が発現し、一方、「キイトルーダ群」では73%であった。グレード3~5(中等度から重度)の副作用発現率は、「化学療法群」53%、「キイトルーダ群」27%であった。
演者である独 Lung Clinic GrosshansdorfのMartin Reckは「40%以上の被験者がクロスオーバーしたにもかかわらず、全生存期間が著しく改善した」、「すべての評価項目において、ペムブロリズマブが良好であった。」、「このデータは、進行非小細胞肺がんの患者管理(治療)を完全に変えるものになるだろう」、「この試験は、進行非小細胞肺がん患者の30%のPD-L1高発現となる患者における指標となる試験であった。新しい治療アルゴリズムでは、治療開始前にPD-L1発現を確認するべきである」と話した。
なお、本結果はThe New England Journal of Medicine(NEJM)に同日掲載されており、それについてもおって掲載予定。
明暗を分ける結果、オプジーボ、非小細胞がん初回治療にて、有効性示せず
非小細胞肺がんの初回治療として、標準療法である「プラチナ製剤併用療法(化学療法群)」と「オプジーボ単剤療法(オプジーボ群)」を比較した第3相臨床試験(Checkmate026試験)。患者は腫瘍細胞にPD-L1という分子が発現した方(PD-L1発現1%以上。以下、PD-L1発現)に限定され、主要評価である無増悪生存期間の中央判定による解析対象はPD-L1発現5%以上の患者に限定された。なお、EGFR遺伝子変異やALK遺伝子変異が確認された患者は除外された。
Checkmate26試験には541名の患者が登録され、1対1の割合で「化学療法群」と「オプジーボ群」に割り付けられた。また、「化学療法群」に割り付けられた患者は、二次治療にてオプジーボを選択することが可能であった(クロスオーバー可)。
423人が5%以上のPD-L1発現を示し、これにおける主な結果については以下の通り。
・病態進行までの期間である無増悪生存期間(PFS)中央値は、「化学療法群」5.9か月に対して「オプジーボ群」4.2か月となり、有効性を示せず(HR:1.15, 95% Cl:0.91-1.45,p<0.25)。
・全生存期間(OS)中央値は、「化学療法群」14.4か月に対して「オプジーボ群」13.2か月となり、有効性を示せず(HR:1.02, 95% Cl:0.80-1.30)。
・「化学療法群」の92%以上に副作用(治療関連有害事象)が発現し、一方、「オプジーボ群」では71%であった。グレード3~4(中等度から重度)の副作用発現率は、「化学療法群」71%、「オプジーボ群」18%であった。
演者である米Florida Hospital Cancer InstituteのMark A. Socinskiは、「この残念な結果には多くの理由が考えられる」、「非小細胞肺がん初回治療として、ニボルマルとイピリブマブ(ヤーボイ)の併用療法を行うCheckmate227試験に期待する」と話した。
明暗を分ける結果、なぜ、結果が異なったのか?
ディスカッションでは、Keynote24試験とChwckmate26試験の結果が異なった理由が議論されたが、主にKeynote24試験では、PD-L1高発現という、被験者選択を厳密に行ったことが評価された。また、以前から懸念されている通り、PD-L1発現を計測するためのキット(PD-L1抗体)が異なることも示唆。オプジーボとキイトルーダの抗体としてのパワーも議論に上がったとのこと。
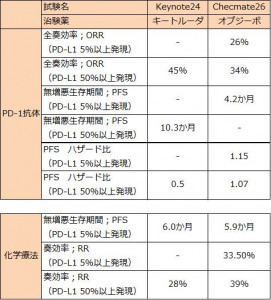
ESMO2016 プレジデンシャルシンポジウム2スライド参照
記事:可知 健太
リサーチのお願い
この記事に利益相反はありません。


