3月24日、小野薬品工業株式会社とブリストル・マイヤーズスクイブ社は、PD-1抗体ニボルマブ(商品名オプジーボ)」について、「再発又は遠隔転移を有する頭頸部がん」に対する国内製造販売承認事項一部変更の承認を取得したと発表した。オプジーボは、頭頸部がんの治療薬として日本で承認された初めての免疫チェックポイント阻害薬となる。
頭頸部がんは頭頸部領域に発生する悪性腫瘍の総称であり、原発部位には口唇、口腔、鼻腔、副鼻腔、上咽頭、中咽頭、下咽頭、喉頭、大唾液腺および粘膜悪性黒色腫があり、国内における年間患者数(甲状腺がんを除く)は約2万4千人と推定されている。
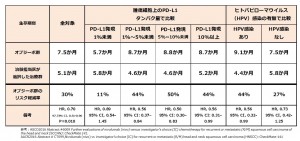
オプジーボは、プラチナ製剤を含む化学療法後に再発または病勢進行した、および局所治療が適応とならない頭頸部がん患者において、対照群(治験担当医師が選択した治療)と比較して、生存期間の延長を示した世界で初めての治療薬である。さらに、オプジーボは対照群と比較して、生活の質の改善が確認された。
日本人を含む再発または転移性頭頸部扁平上皮がん患者を対象とした国際共同第Ⅲ相臨床試験(Checkmate-141試験)において、主要評価項目である全生存期間は、オプジーボ群で7.49ヵ月と、対照群の5.06ヵ月に対して統計学的に有意な延長を示した(ハザード比0.70;p=0.0101)。本試験におけるオプジーボの安全性プロファイルは、これまでの臨床試験の結果と一貫しており、新たな安全性シグナルは認められなかったとのこと。
有効性についての詳細は以下を参照
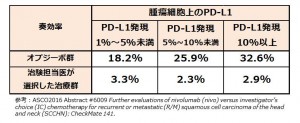
プラチナ製剤治療歴を有す頭頸部扁平上皮がん オプジーボの有効性を示唆 ASCO2016(オンコロニュース2016/06/18)より抜粋
日本では唾液腺がん等の腺がんでも使用可能となるが・・・
米国では2016年11月10日に、「プラチナ製剤を使用後に進行した転移・再発性の頭頸部扁平上皮がん(SCCHN)」は承認されている。これは先にあげたCheckmate-141試験が頭頸部扁平上皮がん対象として実施された試験であるためだ。
しかしながら、今回の日本の承認では扁平上皮がんに限定せず、唾液腺がん等の腺がんにも適応を認めている。ただし、腺がんに対するエビデンスが乏しく、今後の臨床研究等にてエビデンス構築されると考えられる。よって、頭頸部がんであるものの腺がんの方は、主治医とよく相談する必要があるだろう。
記事:可知 健太
リサーチのお願い
この記事に利益相反はありません。