6月3日~6月7日にシカゴで開催されている米国臨床腫瘍学会(ASCO:あすこ)のAnnual Meeting(年次会議)にて、「プラチナ製剤による治療歴を有する進行頭頸部扁平上皮がん(SCCHN)患者を対象とた免疫チェックポイント阻害薬PD-1抗体ニボルマブ(オプジーボ)の第3相臨床試験(CheckMate141試験)」が、米ピッツバーグ大学Robert L. Ferris氏によって発表された。
本試験は、プラチナ製剤による治療歴を有する再発または転移性頭頚部扁平上皮がん患者361人を対象に、「オプジーボ;240人」または「治験担当医が選択した治療(メトトレキサート、ドセタキセル、またはセツキシマブ);121人」を使用した際の有効性を検討した試験となります。
目次
オプジーボの1年生存率は約2倍(17%から36%)
全対象、腫瘍細胞上のPD-L1タンパク質の量、ヒトパピローマウイルス(HPV)感染の有無における生存期間の比較は以下の表通り。
(AACR2016のものからアップデートされている情報はPD-L1発現量の細分化)
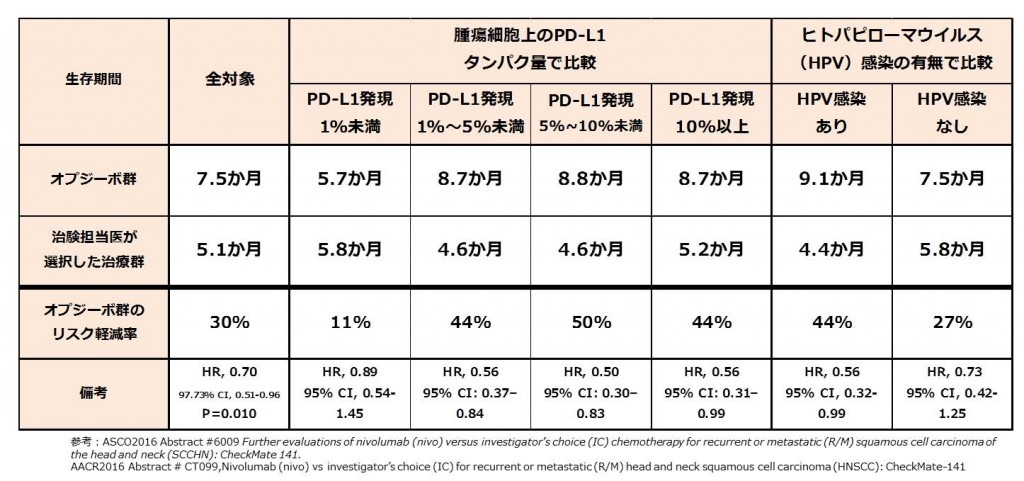
*HPV検査は口腔・咽頭がんの患者に対して実施
2年生存率はオプジーボ群36%、治験担当医が選択した治療群17%と、2倍程度延長した。
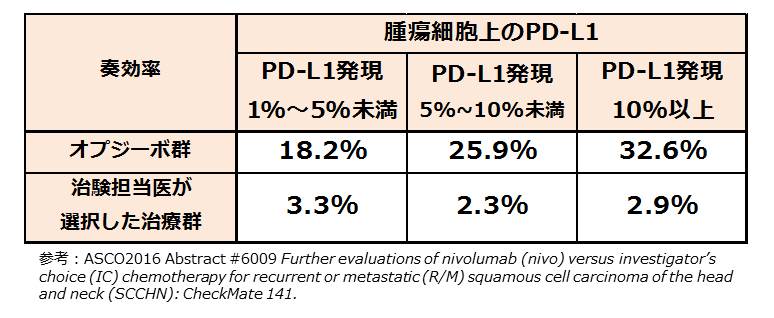
なお、奏効率はPD-L1発現量に依存して増加した。
安全性
本試験におけるオプジーボの安全性面については、これまでの他の試験結果と一貫しており、新たな懸念は認められていない。。
・重症度を問わない全体の副作用割合は、「オプジーボ群58.9%」、治験担当医師が選択した治療群77.5%」
・グレード3~4(中等度から重度) の副作用は、「オプジーボ群13.1%」、治験担当医師が選択した治療群35.1%」
・薬剤に関連する死亡例がオプジーボで2 例(肺臓炎および高カルシウム血症)、治験担当医師が選択した治療群では1例(肺感染症)
本試験は、あらかじめ計画されていた中間解析の結果に基づき、2016年1月に有効性を考慮して早期中止した。また、この結果を受けて、4月25日、FDA(米国食品医薬品局)は、オプジーボを「プラチナ製剤による治療歴を有する再発または転移性頭頚部扁平上皮がん」のbreakthrough therapy(画期的新薬)として認定している。
記事:可知 健太
リサーチのお願い
この記事に利益相反はありません。