2020年7月9日(木)、オンラインにてメディアセミナー『今ある薬を、使えるようにするために―Wanna Be a part of History ?―』が開催された。本セミナーは日本初患者発案の医師主導治験、KISEKI trialの実施背景や意義や課題について、日本肺がん患者連絡会 理事長、NPO法人肺がん患者の会ワンステップ 理事長 長谷川 一男さん、近畿大学医学部内科学講座腫瘍内科部門 主任教授、認定特定NPO法人西日本がん研究機構 理事長 中川 和彦先生、近畿大学医学部内科学講座腫瘍内科部門ゲノム医療センター 武田 真幸先生がそれぞれのテーマごとに講演をした。
このKISEKI trialとは日本で初めて患者が発案した医師主導治験である。通常の治験であれば、製薬企業やまたは医師が企画をして実施されるが、この試験では患者が発案し、医師と協働して実施される。
セミナーは以下の3部構成で進められた。
講演1「治験の背景と経緯」
長谷川一男(日本肺がん患者連絡会 理事長)
講演2「患者と協業する初めての治験・その意義」
中川和彦(認定特定NPO法人西日本がん研究機構 理事長)
講演3「治験の詳細と課題」
武田真幸(近畿大学医学部内科学講座腫瘍内科部門/ゲノム医療センター)
目次
“奇跡”を“軌跡”に変えたい
セミナー冒頭、長谷川さんは「参加ができなかったという患者さんの後悔を無すくためにも、この治験の存在を多くの人に届けてほしい。またこの治験の意義をみなさんに知ってほしいです」と述べた。
臨床試験(治験)は医療者、製薬企業、患者(被験者)の多くの協力があり成立し、標準治療となっている。「これまで製薬企業や医師が主導して治療が開発されてきた。この大きな流れの中で、今度は我々、患者の立場からも開発に積極的になる番だ」を自身の思いを語った。
この様に思ったきっかけは2018年夏にオシメルチニブ適応拡大のニュースだ。EGFR陽性の肺がん患者が1次治療で使用できるようになった。この時長谷川さんと「1次治療から使用できる様になったのは喜ばしいことであるが、数万人の肺がん患者が効果のあるかもしれない薬剤が使えずに置き去りが起きている」と感じた。
「T790M耐性変異がないと使えない。しかし奏効率約20%は肺がん治療において3剤目になると奏効率10%程度と比較すると効くといえるのではないか。加えて、脳にも届くといった特徴もある」と話した。
「現状エビデンスがないなら、臨床試験を実施しなければならない」そう思った長谷川さんは、市民公開講座の控室で偶然中川先生と一緒になり、そこで「患者会がお金を集めたら治験をやってもらえますか?」と覚悟を決め尋ねた。「はい、できます。しかし運営費で2億円かかります。薬剤費には10億円以上かかります」と中川先生は真剣な表情で答えた。長谷川さんはあまりの金額に卒倒しそうになるも、「製薬企業に要望書を出してみましょう」と中川先生は付け加えたことで、治験実現に向け大きな一歩を踏み出した。
製薬企業に要望書を提出すると、「検討する」との返答を得て、医師主導治験を行うに際しての大きな一歩を踏み出した。
最後に、「この治験の名前をKISEKI試験と名付けました。“奇跡”と“軌跡”の2つの意味があります。“奇跡”は患者・家族、医療者、製薬会社含めて実現に至ったのは、皆が様々な壁を乗り越えた“奇跡”だから。“軌跡”はその奇跡を奇跡に終わらせず、道を残すこと(軌跡にする)を決意する。この2つの意味を込め、“奇跡”を“軌跡”に変えたい」と講演を締め括った。
患者さんからの発案がなかったら実現していない試験
はじめに中川先生は「臨床試験とはヒトを使って治療方法を比較し優劣を決めることである」と説明した。また、臨床試験の結果が受け入れられる条件として、
- 誰もが納得できるルールが前もって決められている
- 実施計画書が科学的、合理的、倫理的である
- ルールに従って的確に行われたことが検証できる
を挙げた。
臨床試験の中で新薬の開発、承認を目的として行われる試験を治験といい、治験と医師主導治験の違いについて、「治験は製薬企業が承認申請の為に実施する試験で一方で医師主導治験は医師のアイディアによって未承認薬を用いて実施する試験である」と述べた。また患者会が集めた寄付の一部は、治験参加の通院のための旅費宿泊費の補助として使われる。
加えて、医師主導治験と今回の長谷川さんら患者が発案した患者提案型医師主導治験について「GCPという省令に従って医師の全責任を持ち、治験を行う点では変わりないが、患者ニーズを満たす為に、患者も被験者募集等、広報に協力し、一部資金面でも協力する点が違いである。」と述べ、「アメリカだと患者会が莫大な基金を持っており、いくつもの大型の患者提案型医師主導治験が行われています」と付け加えた。
患者提案型医師主導治験の意義について、「製薬企業も医師も基本的にはPatient firstです。しかしながら製薬企業は営利企業であり、企業戦略に沿って臨床試験を実施します。医師も病院経営や研究を続ける為に資金が必要です。よって医師も製薬企業のスコープ(戦略)に沿って治験を実施します。従って、時として患者のニーズに応えられず、ある意味孤立する場合があります。」と今までの日本の治験の進め方について述べ、「しかし今回の試験は患者さんからの発案があり、それがなければ実施していないであろう、デザインの治験が実現した」とも語った。
Take Home Messageとして以下を挙げセッションを締めくくった。
- 臨床試験とは、治療法の直接対決
- そのルールには、倫理指針、臨床研究法、GCPの3つがある
- 治療開発における製薬企業、医師、患者の関係から患者は孤立傾向にある
- 患者提案型医師主導治験は、製薬企業と研究者がpatient Firstに立ち返る転機
早く登録が進めば、早く解析ができ、結果が出せる
まず初め武田先生はタグリッソの添付文書を用いて、「EGFR遺伝子変異が陽性であれば、初回治療で使用することができます。しかし初回治療でタグリッソ以外のEGFRチロシンキナーゼ阻害剤で治療し、その後病勢が進行した患者さんのうち、T790M耐性変異が確認された場合にのみ、タグリッソを使用することができます」と効能効果について解説した。
臨床上の課題について、「第1世代、第2世代のEGFRチロシンキナーゼ阻害剤を使用している患者さんのうち約13〜19%の患者さんは、これらの薬剤が血液脳関門を通過しにくいために、脳転移のみ増悪します。一方でタグリッソは脳移行が良いとされているため、脳転移のみ再発を繰り返す患者さんには効果的ではないかと考えられています」を補足した。
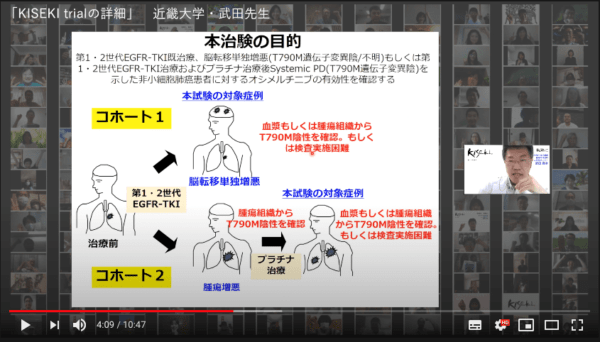
治験のデザインについては「コホート1とコホート2に分かれ、初回治療に第1世代、第2世代のEGFRチロシンキナーゼ阻害剤を使用した患者さんについて、コホート1は脳転移で再発し、T790M遺伝子変異陰性もしくは検査が困難な症例。コホート2は原発の再増悪等、全身増悪し、T790M変異陰性と確認され、その後プラチナ製剤で治療後、再生検でT790M変異陰性と判定され、病性進行が認められた症例です」と説明した。
「コホート1では主要目的は脳転移の主要縮小割合で期待奏効割合は60%目標登録数は17例、コホート2では主要目的は全身の奏功割合で期待奏効割合は25%で目標登録数は53例。試験期間は4年間でうち登録期間は3年、追跡期間は1年としています」と早く登録が進めば、その分早く解析ができて、結果を出す期間が短縮できると述べた。
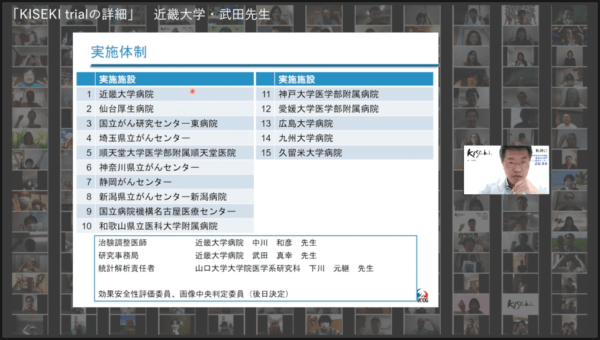
治験の実施施設は患者さんのアクセスのしやすさを考慮し、「全国の均等に施設には参加いただいています。8月中の倫理委員会を通過予定なので、患者さんはアクセスしやすい施設を選んでください」と述べた。
「適格基準について細かく説明していないため、興味のある患者さんは“臨床研究情報ポータルサイト”をご覧ください。」補足され、最後に「8月中の開始を目指し、準備をしています。本治験の適格性については、主治医を介して近隣の治験実施施設までお問合せください」と締め括った。