11月10日、米Bristol-Myers Squibbは、アメリカ食品医薬品局(FDA)が免疫チェックポイント阻害薬PD-1抗体ニボルマブ(オプジーボ)が、「プラチナ製剤を使用後に進行した転移・再発性の頭頸部扁平上皮がん(SCCHN)」の適応にて承認したと発表した。
この承認は、、「プラチナ製剤による治療歴を有する進行頭頸部扁平上皮がん(SCCHN)患者を対象とた免疫チェックポイント阻害薬PD-1抗体ニボルマブ(オプジーボ)の第3相臨床試験(CheckMate141試験)」の結果によるもの。
Cehclmate141試験は、プラチナ製剤による治療歴を有する再発または転移性頭頚部扁平上皮がん患者361人を対象に、「オプジーボ;240人」または「治験担当医が選択した治療(メトトレキサート、ドセタキセル、またはセツキシマブ);121人」を使用した際の有効性を検討した試験である。
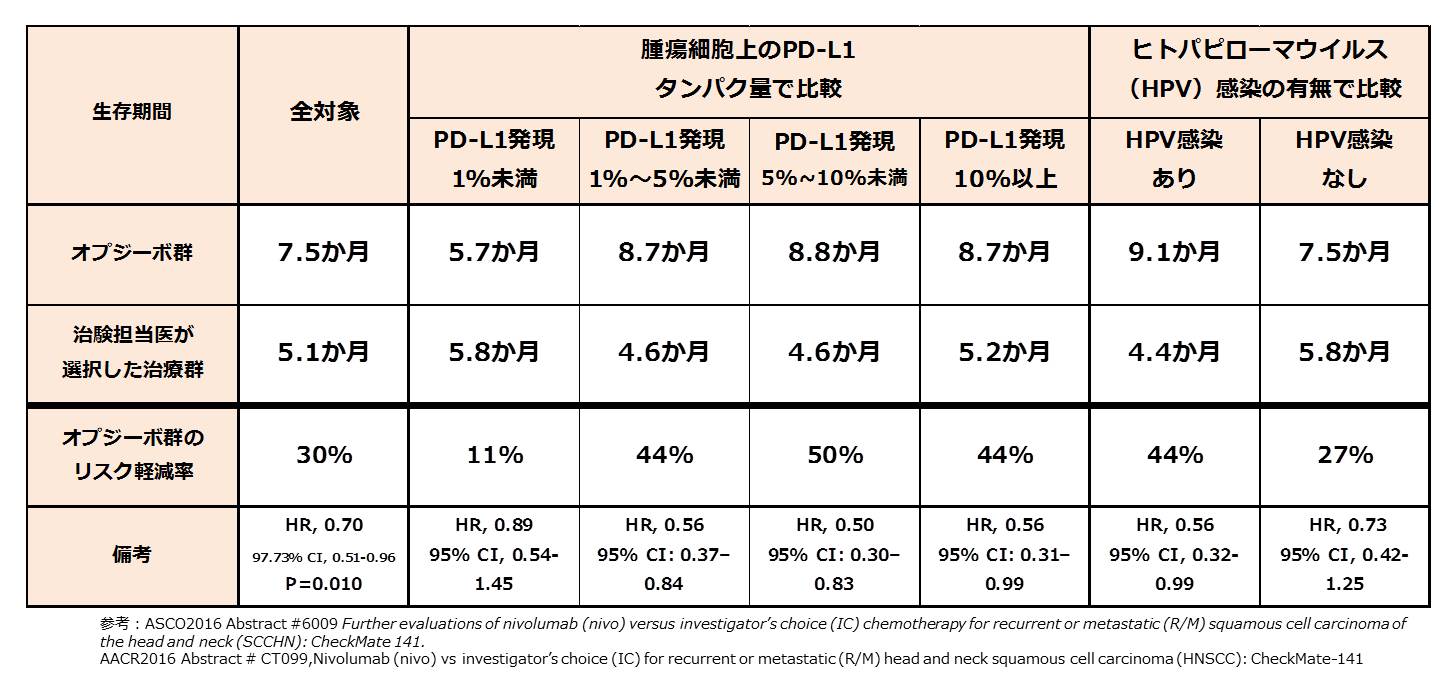
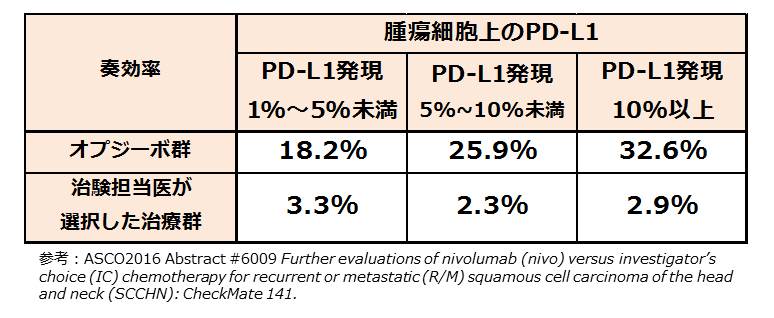
結果、全生存期間はオプジーボ群7.1か月、治験担当医が選択した治療群5.1か月であり、死亡リスクを30%を軽減した (HR=0.70 [95% CI: 0.53-0.92; p=0.0101])。
本試験におけるオプジーボの安全性面については、これまでの他の試験結果と一貫しており、新たな懸念は認められていない。
プラチナ製剤治療歴を有す頭頸部扁平上皮がん オプジーボの有効性を示唆 ASCO2016(オンコロニュース20160602)
頭頸部扁平上皮癌としては、ペムブロリズマブ(キイトルーダ)が8月5日にFDA承認されており、免疫チェックポイント阻害薬としては2剤目。
日本においては、2016年7月27日に「再発又は遠隔転移を有する頭頸部がん」に対する効能・効果に係る製造販売承認事項一部変更承認申請を行っている。
免疫チェックポイント阻害薬オプジーボ 進行頭頸部がん適応にて承認申請(オンコロニュース20160602)
記事:可知 健太
リサーチのお願い
この記事に利益相反はありません。