クリゾチニブ(商品名ザーコリ)による治療を受けるほとんどのALK遺伝子変異陽性非小細胞肺がん(NSCLC)患者は、最終的にPDとなってしまう。第2相臨床試験(ALTA試験、(NCT02094573)では、クリゾチニブ抵抗性ALK陽性NSCLCにおいて、次世代ALK阻害剤であるブリガチニブ(治験薬コードAP26113、米国商品名LUNBRIG)の2つのレジメンを評価した。
被験者はブリガチニブ90mgで7日間導入後、無作為に90mg1日1回経口投与(A群)と180mg1日1回((B群)に割り付けられた。主要評価項目は治験担当医評価による客観的奏功率(ORR)であった。
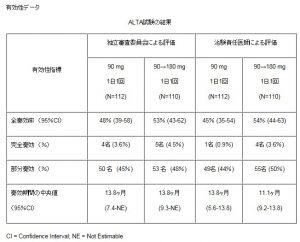
治験に参加した患者は222例(A群:112例、治療109例、B群:110例、治療110例)であり、うち154例(69%)は脳転移を有し、164例(74%)が化学療法を受けていた。
追跡期間中央値は8.0ヶ月、奏効率(ORR)はA群で45%(97.5%CI:34%〜56%)、B群で54%(97.5%CI:43%〜65%)であった。無増悪生存期間(PFS)中央値は、A群9.2ヶ月(95%CI:7.4〜15.6)、B群12.9ヶ月(95%CI:11.1〜未達)であった。
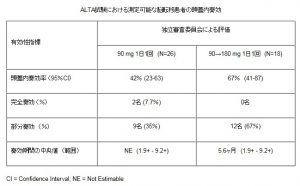
脳転移を有する患者における独立評価委員会評価による頭蓋内奏効率はA群で42%(26人中11人)、B群で67%(18人中12人)であった。
一般的な治療時の有害事象は、悪心(A群33%、B群40%)、下痢(A群19%、B群38%)、頭痛(A群28%、B群27%)、咳(A群18%、B群34%)で、主にGrade1〜2であった。早期発症(中等度発症:2日目)の呼吸器関連有害事象は、219例中14例(全Grade6%、Grad3以上3%)で発現したが、180mgへのエスカレーションしたB群には発現しなかった。また、この14人の患者のうち7人がブリガチニブの再治療が可能であった。
ブリガチニブは、良好な全身および頭蓋内奏効と無増悪生存期間をもたらした。180mgは90mgより一貫して優れた有効性を示し、安全性は許容されるものであった。
FDA(米国)はクリゾチニブ抵抗性となったALK遺伝子転座陽性非小細胞肺がん適応にてブリガチニブを承認
5月1日、武田薬品工業株式会社は、ALTA試験の結果を受けて、米国食品医薬品局(FDA)により、ブリガチニブが「クリゾチニブ投与中に進行した、あるいはクリゾチニブ不認容の未分化リンパ腫キナーゼ遺伝子転座陽性(ALK陽性)の転移性非小細胞肺がん」適応にて、迅速承認したされたと発表した。
記事:加藤 テイジ
リサーチのお願い
この記事に利益相反はありません。