・患者の腫瘍から取り出した腫瘍浸潤リンパ球をIL-2にて活性化。その後、がん細胞を認識するT細胞のみを取り出し体内に戻すという極めて高度な個別化免疫療法。
・結果の解釈、特に日本のがん免疫クリニックで行われている活性化リンパ球療法とは異なることに注意したい。
複数の化学療法に抵抗性を示していたエストロゲン受容体(ER)陽性HER2陰性の転移性乳がんの女性患者(当時49歳)に対し、自身の腫瘍組織に由来する腫瘍浸潤リンパ球(tumor infiltrating lymphocyte;TIL,ティル)を移入し、その前後で抗PD-1抗体のペムブロリズマブ(商品名キイトルーダ)を投与したところ、がん病変の完全退縮状態が22カ月を超えて持続しているという。米国立がん研究所(NCI)のSteven A. Feldman氏らの研究グループが実施した臨床試験に参加した1症例に関する報告で、2018年6月4日のNature Medicineオンライン版に掲載された。極めて高度な個別化細胞免疫療法で、この症例に認められた完全退縮には自家TILが寄与し、キイトルーダ単独療法でみられる効果とは異なることが示唆された。
目次
従来の活性化リンパ球療法とは異なる、極めて個別化された免疫療法
同症例から採取したがん組織小片に由来するTILを高濃度のIL-2(インターロイキン2)の共存下で培養し、非同義変異(アミノ酸の置換を伴う変異)に基づくスクリーニングを行った。症例独自の腫瘍特異的な変異抗原(ネオアンチゲン)として、SLC3A2、KIAA0368、CADPS2、およびCTSBが特定された。これらの変異ペプチドに反応する細胞の中から、T細胞受容体(TCR)を指標とする細胞仕分け(ソーティング)、および1細胞ごとの遺伝子解析により、ネオアンチゲンに反応するT細胞クローンの型(クロノタイプ)を同定した。こうしたプロセスを経て、治療用のTIL細胞製品を調製した。
Note:自己の腫瘍組織から腫瘍浸潤リンパ球(TIL)を取り出しサイトカインの一種であるIL-2にて培養してから体内に戻す、いわゆる「活性化リンパ球療法(LAK療法)」は1980年代に、本研究者の一人であるSteven Rosenberg氏にて開発された養子免疫療法(細胞免疫療法ともよぶ)の一種である。しかしながら、IL-2による活性化のみでは、がん抗原非特異的(腫瘍細胞のみを敵と認識していない)という欠点があった。
今回の研究が通常の活性化リンパ球療法と異なるのは、すでに腫瘍細胞に浸潤しているもリンパ球を取り出してIL-2にて刺激し、更には、その中でネオアンチゲンといわれる腫瘍抗原に対して反応するT細胞のみを取り出した点となる。それゆえ、非特異性を完全に排除したわけではないが、極めて特異性が高い活性化リンパ球療法といえる。
なお、同じ養子免疫療法でも、CD19のような遺伝子を導入するキメラ抗原受容体(CAR)遺伝子導入T細胞療法(CAR-T)とは異なる。
キイトルーダを併用しているが、併用による上乗せ効果は不明瞭
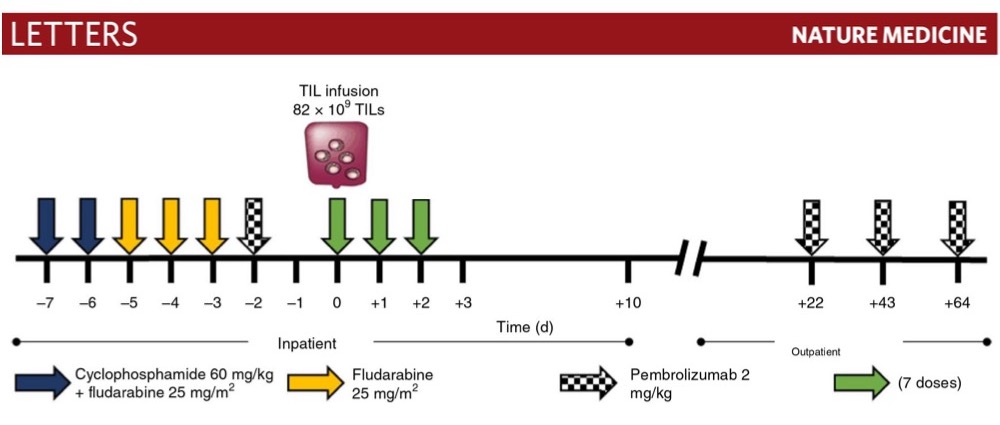
TIL移入前の処置(シクロホスファミド(60 mg/kg, ) and fludarabine (25 mg/m2)+フルダラビン併用投与)を行った後、上記TIL製品(820憶個)を1日1回、計3回にわたり静注した。キイトルーダは初回TIL静注の2日前、22日後、43日後、および64日後に2mg/kgを静注した。この細胞製品に含まれる細胞の62.5%はエフェクターメモリー表現型のCD4陽性細胞で、ネオアンチゲンのSLC3A2、KIAA0368に対する反応性が維持されていること、CD3陽性細胞のおよそ21%はPD-1を発現していることなどを確認した。そして、細胞静注の6カ月後の初回評価で、腫瘍量は50%減少し、22カ月後の放射線画像では、標的病変、非標的病変の全てが消失していることを確認した。
腫瘍完全退縮という効果に対するキイトルーダの影響を様々な解析を用いて評価したところ、キイトルーダは効果にほとんど、または全く寄与していない可能性が示唆された。治療前に右乳房の病変を急速に増大させていた、TILの資源として採取した腫瘍は、PD-L1陽性の間質を伴うCD3陽性PD-1陽性T細胞が豊富に存在していたが、腫瘍細胞にはPD-L1は発現していなかったというのが理由の1つである。複数の治療に抵抗性を示していた治療前の胸壁生検標本では、CD3陽性PD-1陽性の限局した小領域があり、腫瘍や間質にはPD-1リガンドであるPD-L1の発現は認められなかった。
悪性黒色腫や喫煙に誘発される肺がんなど体細胞変異の頻度が高いがんと異なり、乳がんや卵巣がんといった体細胞変異の頻度が低い上皮性のがんは、免疫チェックポイント阻害薬や活性化リンパ球療法の効果を得られる可能性が低いと考えられている。また、キイトルーダについては、トリプルネガティブ乳がんに対する効果については第2相試験(Keynote086、NCT02447003)にて有効な可能性が示唆されており第3相試験が実施されているが、ホルモン受容体(HR)陽性乳がんに対する活性を示す報告もない。
Note:先に述べたように、特異性が高いT細胞を戻す点が従来とは異なる。しかしながら、免疫チェックポイント分子によるT細胞の攻撃抑制が起こりうるため、それを抑制する抗PD-1抗体(今回の場合は、キイトルーダ)を組み合わせている。しかしながら、本患者では、腫瘍細胞にPD-L1が殆ど発現していないなどがわかり、実際には抗PD-1抗体を併用する意味をなさなかった可能性がある。
【参考】トリプルネガティブ乳がんのキイトルーダ単剤療法と腫瘍浸潤リンパ球(TIL)との関係を示唆する発表。
転移性トリプルネガティブ乳がん患者に対するキイトルーダ単剤の効果予測因子としての腫瘍浸潤リンパ球(TIL)~欧州臨床腫瘍学会(ESMO2017)より ~(オンコロニュース2017/9/13)
技術発展による新たな可能性
採取した患者自身のTILを体外で拡大培養して活性化し、体内に戻す養子免疫療法は以前から行われ、一定の効果が報告されていたが、従来の治療と今回の細胞免疫療法が異なる点は、近年飛躍的に進歩した1細胞ごとのシーケンス技術が大きく貢献したことで、ネオアンチゲンを特定して変異蛋白質に特異的なT細胞受容体(TCR)配列を速やかに同定することができるようになった。独自に変異したネオアンチゲン蛋白質に特異的に反応するTIL細胞製品の調製に成功し、自己の末梢血リンパ球に混入することで免疫の認識環境が整った結果の効果と考えられた。
本研究者の一人であり、養子免疫療法の開発したSteven Rosenberg氏は、「数種類の既存の治療を実施したものの進行した1人の転移性乳がん患者から、がん特異的T細胞を単離して再活性化した。すると、この再活性化T細胞によって患者の転移病変が全て排除され、患者はそれ以来現在まで、2年にわたってがんは再発していない。著者たちは標的となったがん細胞の特性を分子レベルで詳しく調べ、これによって今回の手法が他の乳がん患者で有用かどうかを高い精度で予測できるようになった。ただし、この結果については、もっと人数を増やした比較臨床試験での確認が必要であろう。」と述べている。(NatureAsiaより抜粋)
期待される治療法である一方、研究道半ばであることに注意
この研究結果は、非特異的な養子免疫療法や免疫チェックポイント阻害薬が殆ど効果がないといわれているホルモン陽性乳がんが劇的に縮小し、2年間寛解状態を継続していることは非常に意義深いことであるが、以下の点が注意すべき点である。
1.本報告は、332名の消化管がん、尿路上皮がん、乳がん、婦人科がん患者を対象とした高度個別化養子免疫療法のみ、またはそれにキイトルーダを様々な用法で組み合わせた場合の有効性、安全性を確認する第2相試験(NCT01174121)の1患者に過ぎない。有効性については、更なる検証が必要である。
2.本報告では、安全性について報告がなされていない。現在は、養子免疫療法と免疫チェックポイント阻害薬の併用については、世界中で安全性が検証段階であり、臨床試験下以外でむやみに試して良い状況ではない。本臨床試験も、アメリカ国立がん研究所で行われており、極めて安全面、倫理面に配慮した研究と言える。
3.本治療は従来の「活性化リンパ球療法」とは異なる。我が国の免疫療法クリニックにて扱っている「活性化リンパ球療法」について、いくつかのクリニックのホームページを調べていたところ、このような高度な技術を利用した「活性化リンパ球療法」は存在しなかった。また、本症例において、免疫チェクポイント阻害薬の併用は意味をなさない可能性も考察されている。「従来の活性化リンパ球療法」と「免疫チェックポイント阻害薬」の組み合わせが、このような効果をもたらしているわけではない。
最後に、本結果結果について、日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生はこう意見を示す。
完全緩解が得られたことは患者さんにとっては良かったことと思われる。ただ、この治療の有効性に関しては、あくまで、1例の症例報告に過ぎず、この結果のみで有効性が証明されたわけではない。この治療の副作用も重篤なものがあった(骨髄抑制や発熱性好中球減少症など)ことが報告されている。今後、本当に患者さんに推奨できる治療になるかどうか、有効性の再現性や妥当性があるかどうかを、第二相試験、第三相試験(ほかの治療と比較検討した最終的な臨床試験、第三相試験で有効性が証明されると承認に至ることになる)で証明してもらいたい。それまでは、臨床試験としてのみ行われるべき治療であろう。
前処置であるシクロホスファミドは60mg/kg2日投与は、骨髄移植前処置と匹敵する大量化学療法である。本結果はこのシクロホスファミド大量投与による効果の可能性もあり得る。シクロホスファミド大量投与により、グレード4の骨髄抑制、グレード3の発熱性好中球減少症などの強い副作用が出現した。また、TIL移入時に、IL-2を大用量投与している(720,000 IU/kg IV 8時間ごと:高用量であるため、副作用は発熱、疲労などがひどい。日本では腎がんにしか保険適応になっていない。しかも低用量1回70万単位である)。この治験で、行われた免疫細胞療法は、日本で行われている免疫細胞療法(シクロフォスファミド前処置やIL-2投与は行われていない)とは全く違った副作用のかなり強い治療であると理解すべきである。
文:川又 総江、可知 健太(文責)
この記事に利益相反はありません。


