12月19日、中外製薬株式会社は、NTRK融合遺伝子陽性の固形がんを対象として開発中のROS1/TRK阻害剤エヌトレクチニブの製造販売承認申請を、厚生労働省におこなったと発表した。申請適応のNTRK融合遺伝子陽性であればがん種を問わず使用できるもので、今月承認予定のMSI-H固形がん対象適応の免疫チェックポイント阻害薬ペムブロリズマブ(商品名キイトルーダ)に続き2剤目となる。
また、エヌトレクチニブは先駆け審査指定制度対象品目、希少疾病用医薬品の指定を厚生労働省より受けているため、早期承認が期待される。
しかしながら、NTRK融合遺伝子異常を持つ国内の患者数は不明だが、日本の約2.5倍の人口を有する米国での患者数は1500~5000人と推定され、決して多くはない。
今回の承認申請は、オープンラベル多施設国際共同第II相臨床試験(STARTRK-2試験)および海外で実施した3つの第I相臨床試験(STARTRK-NG試験、STARTRK-1試験、ALKA-372-001試験)の統合解析結果に基づいている。有効性評価は、NTRK融合遺伝子陽性の固形がんの患者さん54名を対象としておこない、安全性評価はこれら4つの試験に登録された355名でおこなった。
なお、エヌトレクチニブは前治療後に疾患が進行または許容可能な標準治療がないNTRK融合遺伝子陽性の局所進行または遠隔転移を有する成人および小児固形がんに対し、2017年5月に米国食品医薬品局(FDA)より画期的治療薬(Breakthrough Therapy)に、同年10月に欧州医薬品庁(EMA)よりPRIME(PRIority MEdicines)にも指定されている。
エヌトレクチニブについて
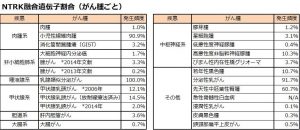
エヌトレクチニブは、ROS1融合遺伝子陽性の局所進行または転移性非小細胞肺がん、またはNTRK1/2/3融合遺伝子陽性の局所進行または転移性固形がんを対象とした臨床開発中の薬剤である。エヌトレクチニブは、ROS1(c-rosがん遺伝子1)およびTRK(神経栄養因子受容体)ファミリーを強力かつ選択的に阻害する経口投与可能なチロシンキナーゼ阻害剤であり、脳転移巣への作用も期待されている。エヌトレクチニブは、ROS1およびTRKキナーゼ活性を阻害することにより、ROS1またはNTRK融合遺伝子を有するがん細胞の増殖を抑制する。エヌトレクチニブは、乳がん、胆管がん、結腸直腸がん、婦人科がん、神経内分泌腫瘍、非小細胞肺がん、唾液腺がん、膵がん、肉腫、および甲状腺がんを含む広範囲の固形がんを対象に臨床試験が行われている。
リサーチのお願い
リサーチ(調査)結果一覧
2018.04.02
- リサーチ
オンコロリサーチについて
2018.02.16
- リサーチ
【オンコロリサーチ】患者さんとご家族を対象としたがんの調査紹介ページ
2018.01.17
- リサーチ
この記事に利益相反はありません。