2月27日、ブリストル・マイヤーズ スクイブ株式会社は、SLAMF7抗体エロツズマブ(商品名エムプリシティ)について、再発又は難治性の多発性骨髄腫の適応で、ポマリドミド(商品名ポマリスト)およびデキサメタゾンとの併用療法として、厚生労働省に製造販売承認事項一部変更承認申請を行ったと発表した。
多発性骨髄腫は、近年、治療法が大きく進歩しているものの、未だ寛解は難しく、治療が奏効しても、次第に効果がなくなり再発する可能性が高い疾患である。
特に再発又は難治性多発性骨髄腫治療においては、免疫調節薬(IMiDs)であるレナリドミド(商品名レブラミド)及びプロテアソーム阻害薬であるボルテゾミブ(商品名ベルケイド)、カルフィルゾミブ(商品名カイプロリス)、イキサゾミブ(ニンラーロ)に対して効果が乏しくなった患者に対して、ポマリストとデキサメタゾンの二剤併用(Pd)療法は一定の有効性を示していましたが、再発に至る場合が多く、より効果的な治療薬が必要とされていた。
今回の申請は、国際共同ランダム化第2相臨床試験であるELOQUENT-3試験(NCT02654132)のデータを根拠としている。
本試験において、エムプリシティ+ポマリスト+デキサメタゾンと三剤併用(E-Pd)とポマリスト+デキサメタゾン二剤併用(Pd)と比較し、有意な無増悪生存期間(PFS)の延長が認められ、主要評価項目を達成するとともに、副次的評価項目である奏効率(ORR)も改善した。また、E-Pd群はこれまで認められているエムプリシティの安全性プロファイルと一致しました。
目次
エムプリシティとは
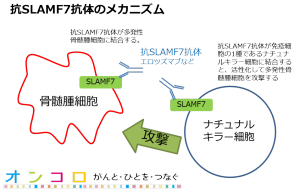
エムプリシティは、細胞表面の糖タンパク質であるSignaling Lymphocyte Activation Molecule Family member 7(SLAMF7)を特異的に標的とする免疫賦活抗体である。
SLAMF7は、細胞遺伝学的異常に関係なく骨髄腫細胞に発現しており、また、ナチュラルキラー細胞や形質細胞、より低いレベルでは、造血系細胞における特定の免疫細胞サブセット上にも発現している。
そのため、エムプリシティは、ナチュラルキラー細胞のSLAMF7に結合して活性化させるのと同時に骨髄腫細胞上のSLAMF7と結合することで、ナチュラルキラー細胞の抗体依存性細胞傷害活性により骨髄腫細胞死を誘導する。
国内では、2016年9月28日に再発又は難治性の多発性骨髄腫の適応で、レナリドミド及びデキサメタゾンとの併用において、厚生労働省より製造販売承認されていたが、今回、ポマリストとデキサメタゾンとの併用療法にて承認された。
ELOQUENT-3試験の結果
ELOQUENT-3試験は、Pd療法に対して抗体医薬の上乗せ効果を検討した世界で初めてのランダム化試験であり、最低9ヵ月の追跡調査の結果、主要評価項目であるPFSの中央値は、E-Pd群で10.25ヵ月、Pd群で4.67ヵ月だった。ハザード比は0.54(95%信頼区間:0.34, 0.86, P=0.0078)となり、E-Pd群でPd群と比較して有意なPFSの延長が認められた。
副次的評価項目であるORRはE-Pd群で53.3%、Pd群で26.3%であり、Pd群と比較しE-Pd群でORRを改善しました(オッズ比4.62, 95%信頼区間:2.05, 10.43)。
E-Pd群の安全性プロファイルについては、Pd群にエムプリシティを上乗せすることにより新たな安全性のリスクが加わることはなく、E-Pd群で発現した注入反応(インフージョン・リアクション)はいずれも軽度で管理可能でした。
この記事に利益相反はありません。