※本記事はEvaluate社の許可のもと、オンコロが翻訳したものです。内容および解釈については英語の原文を優先します。正確な内容については原文をお読みください。
中国で実施された臨床試験は、米国での承認を裏付けることができるのか。抗PD-(L)1阻害薬の投資家はすぐに分かるだろう。
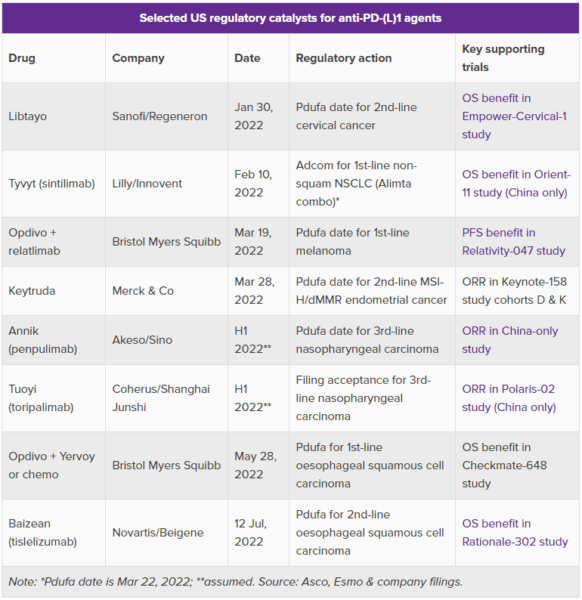
中Innovent社と米イーライリリー・アンド・カンパニーのSintilimab(シンチリマブ)は2月10日に大きなカタリスト(相場を大きく動かす端緒となるイベントや材料のこと)に直面する。抗PD-(L)1抗体としては珍しい米国諮問委員会の開催は、シンチリマブのみならず、中国でのデータを米国における承認の裏付けとしている他の模倣的な免疫チェックポイントモノクローナル抗体の製薬企業にとっても、二者択一の結果を意味する。
新年には、米ブリストル・マイヤーズ スクイブ社のオプジーボ(一般名:ニボルマブ)の新たな使用法(免疫チェックポイント阻害薬としては3種類目の承認を目指す抗Lag-3モノクローナル抗体薬であるrelatlimab(リラトリマブ)との併用)が米国食品医薬品局(FDA)によってまもなく決定される予定である。しかし、より大きな問題は、低価格の抗PD-(L)1市場の未来であり、そのためにはシンチリマブの諮問委員会の結果が極めて重要である。
シンチリマブをめぐる問題は、FDAのオンコロジーセンターオブエクセレンスのディレクターであるRichard Pazdur氏による最近の宣言に集中している。2019年に彼はBiocentury社(米出版社)に対し、中国企業が開発する抗PD-(L)1薬は「欧米の大手製薬会社が価格(の引き下げ)に動くのを見たことがないので、潜在的に皆にとって素晴らしいことかもしれない」と述べていた。
当時、米国では6種類のPD-(L)1薬が販売されていたため、これは価格競争を求める声と受け止められ、これを実現するためにいくつかの取引、特に中Cstone社と米EQRx社の間で取引が行われた。しかし、先月(2021年12月)発表されたNEJM誌の「the Wild West of checkpoint inhibitor development」と題する記事では、Pazdur氏は心変わりしたようで、承認された適応症で使用するためには、米国での直接比較試験が「おそらく必要であろう」との見解を述べている。
さようなら、シンチリマブ?
もしそうであれば、中国ではTyvytとしてすでに販売されているシンチリマブは、米国では大幅に後れを取ることになるかもしれない。Innovent社とリリー社が求める適応は、化学療法との併用による非扁平上皮非小細胞肺がんに対するファーストライン治療であり、キイトルーダ(一般名:ペムブロリズマブ)の有効性はKeynote-189試験により裏付けられている。
しかし、対するシンチリマブのOrient-11試験は、すべて中国で実施され、生存率で有効性を示したものの、比較対象はキイトルーダではなく、化学療法のみであった。米Wells Fargo社のアナリストは、今回の諮問委員会は試験要件のリトマス試験であると述べ、米Bernstein社は、オンコロジー領域の低コストな開発モデルの終焉を予測し、比較試験が必要ならリリー社はシンチリマブから手を引くだろうと見ている。
他の米国後発組はどうなるのだろうか。中Akeso社/中Sino社のpenpulimab(ペンプリマブ)は、中国で行われた非対照試験で認められた寛解率を背景に、鼻咽頭がんの3次治療薬として申請されている。同じ適応症では、米Coherus社が、同じく中国でのみ実施された試験であるPolaris-02試験に基づくtoripalimab(トリパリマブ)の生物製剤ライセンス申請(Biologics License Application: BLA)の段階的申請(Rolling Submission)を開始した。
中Beigene社/スイス・ノバルティス社のTislelizumab(チスレリズマブ)は、食道扁平上皮がんのセカンドライン治療としての米国における承認を待っており、少なくともその裏付けとなるRationale-302試験の参加施設は、中国、台湾、韓国に加えて、米国と欧州の病院で構成されている。
米国の諮問委員会の結果を追っている人は、昨年6月に行われたretifanlimab(レティファンリマブ)のパネル会議で米Incyte社/米Macrogenics社が受けた仕打ちに注目するだろう。会議の結果、反対投票と非承認通知(complete response letter: CRL)が出され、このプロジェクトの承認は数年先送りになった。
一方、抗Lag-3抗体のリラトリマブは、Relativity-047試験の結果を受け、オプジーボとの併用療法で承認されそうだ。処方薬ユーザーフィー法(Prescription Drug User Fee Act:PDUFA)の日付は3月19日であり、諮問委員会はない。開発中期の抗Lag-3抗体を有する企業には、豪Immutep社/ノバルティス社、Incyte社、米メルク社、独ベーリンガーインゲルハイム社、米Regeneron社、Macrogenics社が含まれる。
その前に、仏サノフィ社/Regeneron社のLibtayo(リブタヨ、一般名:セミプリマブ)は、子宮頸がんのセカンドライン治療薬として、米国における承認判断である1月30日のアクション・デート(審査終了目標日)に直面している。米Agenus社のbalstilimab(バルスチリマブ)がこの適応で失敗したのを見た人は、バルスチリマブが対照群のない寛解データに裏打ちされていたのに対し、リブタヨは対照試験であるEmpower-Cervical 1試験において生存率の有効性を示していることに注目するだろう。
また、リブタヨは、中国だけで行われた試験の許容性を懸念している人々にとって、興味深い指標となるものだ。前治療歴のある非小細胞肺がんを対象として1年前に米国で承認されたリブタヨは、米国の病院が1つも含まれていないEmpower-Lung-1試験の結果によって裏付けられた。
PD-(L)1領域における開発とカタリストに関するEvaluate Vantageの最新レポートは、無料でダウンロード可能です。
本記事は、表の誤りを訂正するために修正されました。
■出典
Days of reckoning for immune checkpoint blockers