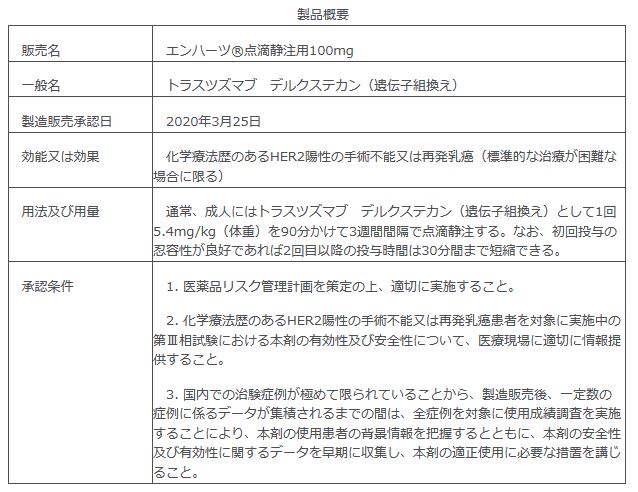
2020年3月25日、第一三共株式会社は抗悪性腫瘍剤トラスツズマブ デルクステカン(遺伝子組換え)(商品名:エンハーツ 点滴静注用 100mg)、HER2に対する抗体薬物複合体(ADC)1について、「化学療法歴のあるHER2陽性の手術不能又は再発乳がん(標準的な治療が困難な場合に限る)」を適応(以下「本適応」)として、国内製造販売承認を取得したことを発表した。
エンハーツは、T-DM1治療を受けたHER2陽性の再発・転移性乳がん患者を対象としたグローバル第2相臨床試験(DESTINY-Breast01、北米、欧州及び日本を含むアジアで実施)の結果に基づき、2019年9月に本適応で製造販売承認申請を行っており、医薬品条件付き早期承認制度2のもとで承認された。
エンハーツの添付文書内「警告」欄に間質性肺疾患(ILD)が記載されている。
1.抗体薬物複合体(ADC)とは、抗体と薬物(低分子化合物)を適切なリンカーを介して結合させた薬剤で、がん細胞に発現している標的因子に結合する抗体を介して薬物をがん細胞へ直接届けることで、薬物の全身曝露を抑えつつがん細胞への攻撃力を高めている。
2.医薬品条件付き早期承認制度とは、重篤な疾患であって有効な治療方法が乏しく患者数が少ない疾患等を対象とする医薬品について、日本での治験実施が困難、あるいは実施可能であっても治験の実施にかなりの長期間を要すると認められる場合に、承認申請時に検証的臨床試験以外の臨床試験等で一定程度の有効性及び安全性を確認した上で、製造販売後に有効性・安全性の再確認等のために必要な調査等を実施すること等が承認条件として付与される制度。本制度が適用された医薬品は優先審査の対象となる。
参照元:
第一三共株式会社ニュースリリース
この記事に利益相反はありません。