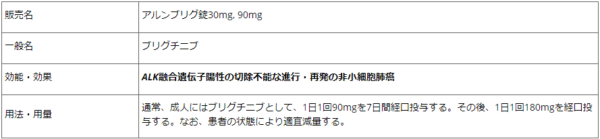
4月23日、武田薬品工業株式会社は、アルンブリグ(R)錠30mg、90mg(一般名:ブリグチニブ、以下アルンブリグ)について、ALK融合遺伝子陽性の切除不能な進行・再発の非小細胞肺がんを適応とする一次および二次以降の治療剤として発売を開始したと発表した。
アルンブリグは、ALKを選択的に阻害する次世代チロシンキナーゼ阻害剤。今回の承認は、ALKチロシンキナーゼ阻害剤治療後に増悪したALK陽性の切除不能な進行・再発の非小細胞肺がん(NSCLC)患者を対象とした国内臨床第2相試験である「Brigatinib-2001(J-ALTA)」およびALKチロシンキナーゼ阻害剤による治療歴のないALK陽性の切除不能な進行・再発のNSCLC患者を対象とした海外臨床第3相試験である「AP26113-13-301(ALTA-1L)」の結果に基づくもの。2020年2月には、厚生労働省に製造販売承認申請を行い、今年1月22日に製造販売承認を取得していた。
武田薬品日本オンコロジー事業部長の堀井貴史氏は、「近年、すぐれた検査方法や治療剤の登場により、ALK陽性NSCLC患者さんの予後は大きく改善しています。しかし、既存治療剤に対する抵抗性や不耐容など、個々の患者さんにおける有効性には依然として課題があることから、新たな治療選択肢が待ち望まれています。本剤は、海外では既に多くの国や地域で承認されており、今回、日本においては治療歴の有無に関わらず、一次および二次以降の治療剤として幅広くALK陽性NSCLC患者さんにお届けできることを非常に嬉しく思います」と述べている。
なお、同剤はALKチロシンキナーゼ阻害剤による治療歴のない、ALK陽性の切除不能な進行・再発のNSCLC患者を対象とした単剤療法の治療薬として、米国、欧州連合(EU)を含む30以上の国または地域で承認されている。また、クリゾチニブ治療後に進行または不耐容となったALK陽性NSCLC患者に対して50以上の国または地域で承認されている。
ALK融合遺伝子陽性非小細胞肺がんとは
近年の遺伝学的研究により、未分化リンパ腫キナーゼにおける染色体の転座が一部のNSCLC患者において重要な因子であることが示されている。転移性NSCLC患者でALK遺伝子に転座が認められる割合は約3~5%とされている。
参照元:
武田薬品工業株式会社 ニュースリリース
肺がんの治験・臨床試験広告
【治験広告】非小細胞肺がん1A期の方を対象とした、PDT治験のご案内
2022.05.16
- 肺がん
- 臨床試験(治験)一覧
- 臨床試験(治験)広告一覧
【治験広告】分子標的薬が効きにくい EGFR陽性の非小細胞肺がんの方対象…
2022.04.01
- 肺がん
- 臨床試験(治験)一覧
- 臨床試験(治験)広告一覧
【治験広告】第1・2世代EGFR阻害薬の治療後に増悪した、T790M変異陰性の肺…
2020.10.01
- 肺がん
- 臨床試験(治験)一覧
- 臨床試験(治験)広告一覧
リサーチのお願い
この記事に利益相反はありません。