※本記事はEvaluate社の許可のもと、オンコロが翻訳したものです。内容および解釈については英語の原文を優先します。正確な内容については原文をお読みください。
米メルク社が最近つまずき、スイスのロシュ社が唯一のプレーヤーである腫瘍免疫学の分野に英アストラゼネカ社が参入するようだ。
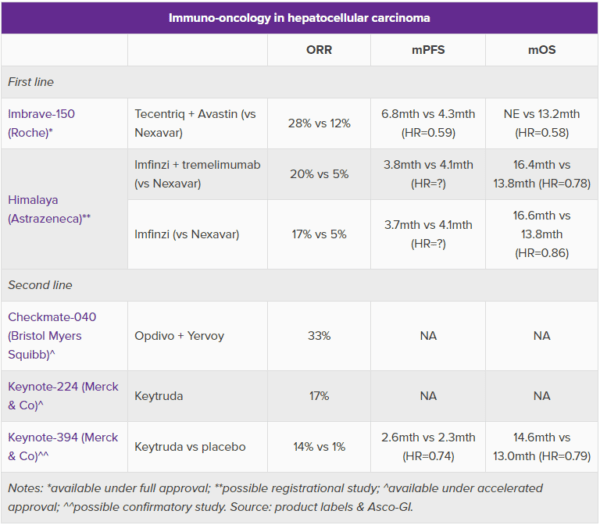
アストラゼネカ社は、イミフィンジ(一般名:デュルバルマブ)とトレメリムマブを併用したHimalaya試験の結果、一次治療において“前例のない”レベルの全生存率を示したと主張しており、肝臓がん治療の地殻変動が再び起こる可能性がある。
今週、Asco-GIで発表されたこの結果は、アバスチン(一般名:ベバシズマブ)との併用療法の一部として、肝臓がんに対する一次治療の適応を持つ唯一の免疫チェックポイント阻害薬であるロシュ社のテセントリク(一般名:アテゾリズマブ)に挑戦することを意図しているが、クロスオーバー試験ベースではまだ優位にある。キイトルーダは、この適応において非承認通知(complete response letter:CRL)を受けたため、メルク社は二次治療での使用をめぐって争うことになった。
Himalaya試験とメルク社のKeynote-394試験は昨年(2021年)、良好な結果を示したが、Asco-GIではフルデータが初めて発表された。Himalaya試験は、トレメリムマブの稀な成功例として注目されており、アストラゼネカ社は、トレメリムマブのプライミング用量300mgの1回投与とイミフィンジを併用し、その後イミフィンジを単独投与するという新しいSTRIDEレジメン(Single Tremelimumab Regular Interval Durvalumab)を使用したことに起因するものであるとしている。
アストラゼネカ社のオンコロジー部門長であるDave Fredrickson氏は、Evaluate Vantageに対し、「このプライミング用量の単一投与が他の腫瘍型にも適用できるかどうかを検討している」と述べた。それだけでなく、このグループは抗CD73、二重特異性抗体、TIGIT阻害など、他の腫瘍免疫学的なアプローチでの同レジメンの応用も検討している。
前例がない?
しかし、全データを見ると、前例のない生存率というアストラゼネカ社の主張には納得しがたいものがある。テセントリクとアバスチンの併用療法は、Imbrave-150試験で死亡リスクを42%減少させたことを背景に承認されたが、アストラゼネカ社の併用療法はHimalaya試験でたった22%であったと、Asco-GIで発表された。
Fredrickson氏は、Himalaya試験で本当に前例がなかったのは3年生存率であり、ネクサバール(一般名:ソラフェニブ)の20%に対して併用療法は31%に達していたと述べた。Imbrave-150試験はこれまでのところ18ヶ月までのデータしか示していないため、この主張に対してロシュ社がどう立ち向かうかはまだわからない。
アストラゼネカ社にとっては、いつ申請するのか、またイミフィンジ単剤とトレメリヌマブとの併用の両方を申請するのかが問題である。1年前に尿路上皮がんの適応が取り消されて以来、肝臓がんはイミフィンジにとって3番目の米国での承認となる。
同グループは、承認申請をしたかどうかは明らかにしないが、昨年10月にHimalaya試験のトップラインデータが発表されるとすぐに規制当局との話し合いが始まったという。「FDAの問題は、(イミフィンジ単剤療法が)適応に入るかどうかということだろう」とFredrickson氏は述べ、「しかし、我々の焦点は併用療法にある」とした。
Himalaya試験でのイミフィンジ単剤治療のコホートは、ネクサバールに対して非劣性を示すのみで優越性は示さず、併用療法よりも成績が悪かったことが既に知られていた。
しかし、Asco-GIでは、16ヶ月ほどの追跡調査において、生存期間の中央値は、併用療法と単剤療法で実際にはかなり近いものであったことを明らかにした。しかし、試験全体では、イミフィンジ単剤での死亡リスクは14%(の減少)とあまり印象的ではなかった。
他のがん免疫療法薬も肝臓がんの一次療法ではうまくいっていない。米ブリストル・マイヤーズ スクイブ社のオプジーボ単剤のCheckmate-459試験は失敗に終わり、メルク社/エーザイ社のキイトルーダとレンビマの併用療法は、非対照のKeynote-524試験で十分な裏付けが得られず、米国のCRLを受けた。
メルク社の次の希望は、同じ併用とレンビマ単剤の比較試験であるLeap-002試験であり、7月に終了する予定である。一方、Asco-GIでは、キイトルーダが2018年に迅速承認された二次治療の適応を正式なものとするのに役立つかもしれない対照試験であるKeynote-394試験のデータを発表している。
ここでのメルク社の大きな問題は、Keynote-394試験がアジアで実施されたことであり、米規制当局がそれを受け入れるかどうかは不明であるということだ。これについて問われたメルクグループは、同試験は同社の肝臓がんの世界的開発プログラムの7つのうちの1つに過ぎず、「エビデンスを蓄積する」とVantageに述べたが、このデータが米国での検証的試験の可能性として規制当局と議論されていることを確認した。
さらに、Keynote-394試験のデータは、圧倒的に強力とは言い難い。ベストサポーティブケア(BSC)に対して死亡リスクが21%減少したが、生存期間の中央値は1.6ヶ月しかなく、奏効率もクロスオーバー試験ベースでオプジーボ+ヤーボイ(一般名:イピリムマブ)併用療法を下回っているのである。メルク社によると、キイトルーダに関連する死亡例は、消化管出血、自己免疫性肝炎、軟部組織感染による3例であったという。
肝臓がんの一次治療は、キイトルーダが成果を上げられなかったがん種の1つである。おそらくこれが、アストラゼネカ社が消化器がんへのイミフィンジ+トレメリヌマブ併用療法の足がかりとして役に立つことに期待する理由の1つであろう。
■出典
Asco-GI – immuno-oncology makes progress in liver cancer