8月21日、アストラゼネカ株式会社はオシメルチニブ(商品名タグリッソ)について、「EGFR遺伝子変異陽性の手術不能又は再発非小細胞肺癌」を適応症とする製造販売承認事項一部変更の承認を取得したことを発表した。タグリッソは、本適応の審査過程において、本年2月に厚生労働省より優先審査品目に指定されていた。
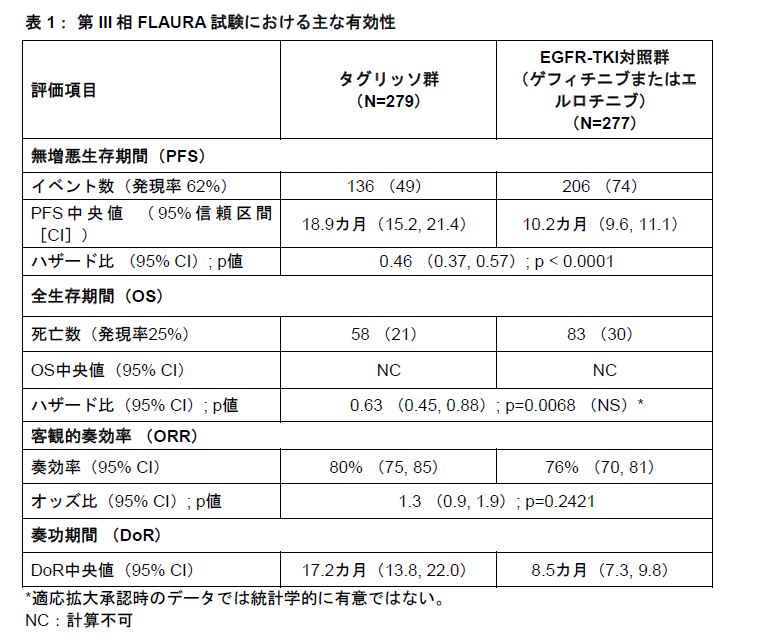
今回の適応拡大は、第III相FLAURA試験の結果に基づいて承認された。同試験において、タグリッソは18.9カ月の無増悪生存期間(PFS)中央値を達成し、EGFR-TKI対照群と比較し統計学的かつ臨床的に有意な改善を示した(表1参照)。
また、これらの改善は脳転移の有無に関するサブグループを含む、解析を行ったすべてのサブグループにおいて一貫して認められた。さらに、安全性についても忍容性が確認された。
本承認取得に先立ち、2018年7月31日には、「コバス®EGFR 変異検出キット v2.0」(製造販売元:ロシュ・ダイアグノスティックス株式会社)がタグリッソのコンパニオン診断薬として、製造販売承認事項一部変更の承認を取得している。
これにより、転移性EGFR遺伝子変異陽性非小細胞肺がんの1次治療薬としてのタグリッソ投与判定補助に用いられるEGFR遺伝子変異は、血漿・組織両検体からの検出が可能となった。
タグリッソは、2016年3月に「EGFRチロシンキナーゼ阻害薬(TKI)に抵抗性のEGFR T790M変異陽性の手術不能又は再発非小細胞肺癌」の適応で、本邦において承認された。
転移性EGFR遺伝子変異陽性非小細胞肺がんの1次治療としての承認は、本邦以外では、米国、欧州で承認されており、他国の承認審査および承認申請も進行中である。
本承認は主に第III相FLAURA試験の結果に基づいている。
FLAURA試験は、前治療歴のない局所進行あるいは転移性EGFR遺伝子変異陽性非小細胞肺がん患者さんを対象とし、タグリッソ80mg1日1回経口投与の有効性および安全性を標準治療であるEGFRチロシンキナーゼ阻害剤 (エルロチニブ [150mg 1日1回経口投与]あるいはゲフィチニブ [250mg 1日1回経口投与])と比較検討した試験である。本試験は、二重盲検無作為化試験であり、29カ国の556例の患者さんを対象としている。
FLAURA試験におけるタグリッソの安全性データは、過去の臨床試験で認められた安全性プロファイルと一貫していた。安全性評価対象症例279例中253例(90.7%)に副作用が認められ、よく見られた症状は、発疹/ざ瘡等(54.5%)、下痢(49.5%)、皮膚乾燥/皮膚炎等(33.3%)、爪の障害(爪囲炎を含む)(32.6%)であった。(適応拡大承認時)
リサーチのお願い
この記事に利益相反はありません。