目次
十分な局所性治療及び術前補助化学療法又は術後補助化学療法を終了した高リスク生殖細胞系BRCA1/2変異陽性HER2陰性原発乳癌患者に対する術後補助療法としてのオラパリブ(リムパーザ)の有効性と安全性を評価する無作為化二重盲検並行群間比較プラセボ対照多施設共同第3相試験
| 対象がん腫 | 乳がん |
| フェーズ | P3 |
| 実施期間 | 2014年4月~ |
| 実施国 | 日本、アルゼンチン、オーストラリア、オーストリア、ベルギー カナダ中国、フランス、ドイツ、イギリス、ハンガリー アイスランド、イスラエルイタリア、オランダ、ポーランド、米国 ポルトガル、大韓民国、スペイン、スウェーデン、スイス、台湾 |
| 目標症例 | 764 |
| 状況 | 募集中 |
| 手法 | 無作為化、二重盲検、並行群間比較、プラセボ対照、多施設共同、安全性/有効性試験 |
| 被験薬名 | AZD2281 (一般名:オラパリブ、 商品名:リムパーザ) |
| 種類 | 分子標的薬(PARP阻害) |
| 投与経路 | 経口薬剤 |
試験概要
<専門的な説明>
本治験は、十分な局所性治療及び術前補助化学療法又は術後補助化学療法を終了したgBRCA1/2変異陽性のホルモン受容体及びヒト上皮成長因子受容体2(HER2)陰性の高リスク原発乳癌患者にオラパリブ(リムパーザ)を術後補助療法として投与したときの有効性及び安全性を評価する無作為化二重盲検並行群間比較プラセボ対照多施設共同第3相試験である。
<一般的な説明>
BRCAというDNA修復に関与する遺伝子に変異がある乳がん患者さんのうち、ホルモン受容体陰性(ホルモン製剤の効果が乏しいと予想される)且つHER2陰性(トラスズマブ:商品名ハーセプチンという分子標的薬の効果が乏しいと予想される)患者さんに対して十分な手術前や手術後に薬剤治療を行った方に対して、オラパリブ(リムパーザ)とプラセボ(偽薬)を使用した場合の効果と安全性を確認する試験です。
治験薬剤の説明
<専門的な説明>
Olaparib は、革新的なファースト・イン・クラスの経口ポリADPリボースポリメラーゼ(PARP)阻害剤で、DNA修復経路に異常をきたしたがん細胞に特異的に作用し、細胞死を誘導します。この作用機序により、OlaparibのDNA修復に異常をきたした一連の腫瘍型に作用する可能性が示されています。
卵巣がんに加えて、アストラゼネカは複数の腫瘍におけるOlaparibの可能性の検討を行っており、乳がんの術後補助療法および転移性BRCA遺伝子変異陽性乳がん、BRCA遺伝子変異陽性膵がん、胃がんの2次治療の第III相試験を実施中です。(2014/12/24時点)
アストラゼネカHPプレスリリースより抜粋:http://www.astrazeneca.co.jp/media/pressrelease/Article/20141224
<一般的な説明>
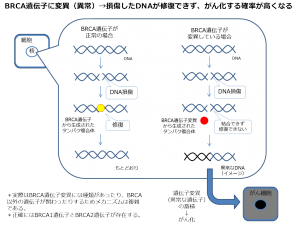
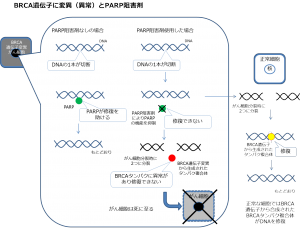
がん細胞のDNAが損傷した時に修復する1つの酵素にPARP(ポリADPポリメラーゼ)というたんぱく質があります。このたんぱく質の機能を阻害(抑制する)ことにより、がん細胞のDNAが損傷した時に修復できず、がん細胞を死滅することができると言われています。2014年には特定の卵巣がんに対して米国やEUにて承認されました。
一方、がん細胞のDNAが損傷したときにBRCAという遺伝子が関与してDNAを修復します。がん細胞のBRCAが変異(異常)であると修復機能が働きません。しかしながら、PARPという酵素はDNAを修復できるタンパク質であり、BRCA遺伝子の代わりにがん細胞のDNAを修復してしまいます。オラパリブ(リムパーザ)はPARPを阻害する機能があるため、特にBRCA遺伝子に異常がある方に効果があると期待されています。
主な参加条件等
この試験の対象となりうる方
- 18歳以上 日本は20歳以上
- 転移のないホルモン受容体陰性(エストロゲン受容体陰性、プロゲステロン受容体陰性)、HER2陰性の乳がんの方
- BRCA1又はBRCA2の変異が認められる方
- 適切な手術が終了されている方
- アントラサイクリン系(ドキソルビシン:商品名アドリアシン、エピルビシン:商品名ファルモルビシン)、タキサン系(パクリタキセル:商品名タキソール、ドセタキセル:商品名タキソテールなど)あるいは両剤の併用による少なくとも6サイクルの術前補助化学療法又は術後補助化学療法を終了済みの方
- ECOG Performance Statusが0~1の方
この試験の対象とならない方
- オラパリブ(リムパーザ)を含むPARP阻害剤による治療を過去に受けたことがある方
臨床試験公開情報
JAPIC No : JapicCTI-142604(更新日:2017/2/27)
ClinicalTrials.gov Identifier:NCT02032823(更新日:2017/10/10)
治験詳細を見る
【JapicCTI】
http://www.clinicaltrials.jp/user/cteDetail.jsp?clinicalTrialId=11594
【Clinical traials.gov】
https://clinicaltrials.gov/ct2/show/NCT02032823
注意
試験タイトルに英語記載がある場合、JAPIC等の日本語公開情報に掲載がないことを意味します。
試験概要の「専門的な説明」は、JAPICやUMINに情報がある場合はそこから、ない場合はClinidcaltrials.govから転記しています。
薬剤の「専門的な説明」は、開発企業に情報がある場合はそこから、ない場合はNCI(National Cancer Institute)から転記しています。
専門的な記載を一般の方がわかるよう記載していますが、当社の認識が誤っていることがありますので、必ず実際の公開情報を確かめてください。
実施医療機関は明記できませんが、実際の公開情報に明記されている場合があります。
主な参加条件には記載された基準以外にも多くの基準があります。
文:可知 健太(最終更新日2015/9/9)
この記事に利益相反はありません。