目次
大腸癌の抗VEGF抗体薬サイラムザ(ラムシルマブ)について
ステージ4大腸がんの治療目的は治癒でなく延命です。つまり、どれだけの期間命を伸ばすことができるかを目的にします。
これまで治療開始から20ヶ月の延命ができれば十分とされてきましたが、分子標的治療薬であるアバスチン(ベバシズマブ)、アービタックス(セツキシマブ)、ベクティビックス(パニツムマブ)の登場により30ヶ月の延命が期待できるようになりました。
次なる期待は40ヶ月、そして治癒。このような期待で2016年5月23日に登場したのが、大腸がんの新薬
サイラムザ(ラムシルマブ)
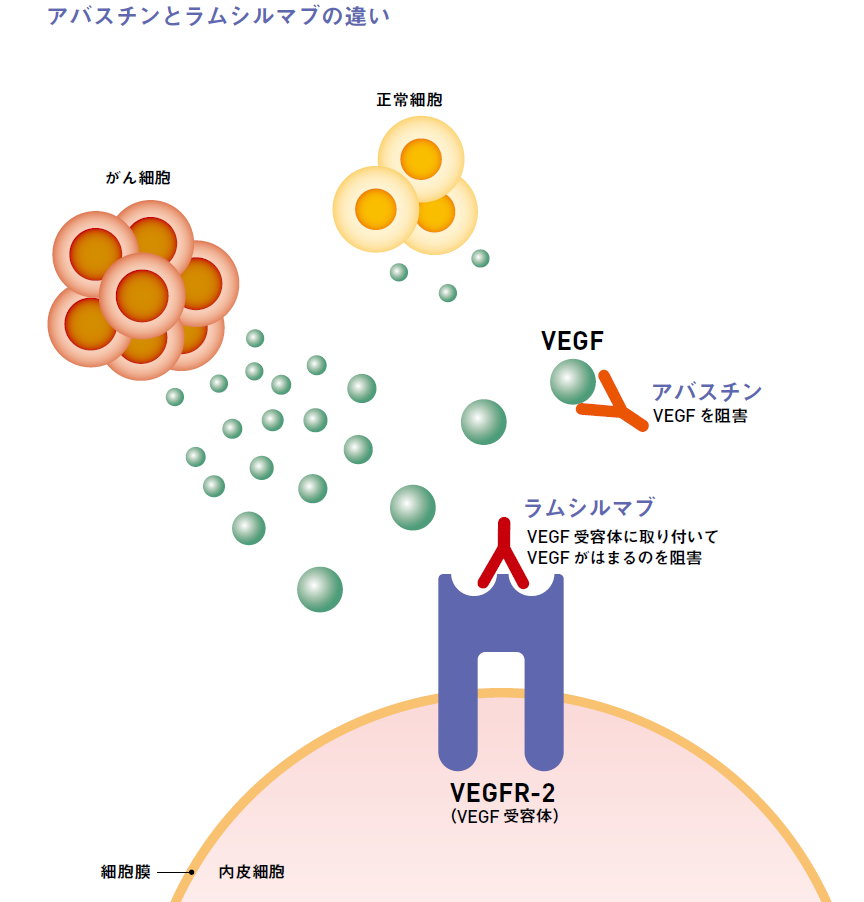
です。サイラムザ(ラムシルマブ)は血管新生阻害薬です。癌細胞は増殖するために栄養と酸素が必要ですが、栄養と酸素は血管を流れる血液から運ばれてきます。癌細胞は自分のところにこれらを効率的に運ぶために新たに血管を作ります。
この血管を作る過程において腫瘍細胞が生成するVEGF(血管内皮細胞増殖因子)と呼ばれるタンパク質が、VEGFR(血管内皮細胞増殖因子受容体)に結合することで新しい血管ができます。この血管新生の過程を阻害するのがサイラムザ(ラムシルマブ)です。
サイラムザ(ラムシルマブ)がこれまでの分子標的薬と決定的に違うと期待されているのは、ステージ4大腸癌患者の二次治療として投与した結果、比較群に対してOS(全生存期間)を明らかに伸ばした点です。
アバスチン(ベバシズマブ)も二次治療として投与した結果、比較群に対してOS(全生存期間)を明らかに伸ばした試験結果がありますが、この結果は一次治療にもアバスチン(ベバシズマブ)を投与しているという条件付きです。
大腸癌患者に対するRAS遺伝子検査の保険適応に伴い、一次治療にアバスチン(ベバシズマブ)でなくアービタックス(セツキシマブ)、ベクティビックス(パニツムマブ)が投与されるようになってきた臨床の背景から、この条件があるのとないのとでは大きな違いになり得る可能性はあります。
しかし、大腸癌の効能が追加されたサイラムザ(ラムシルマブ)は、 治癒切除不能な進行・再発の結腸・直腸癌かつ併用する抗がん剤のレジメンはFOLFIRIという条件付きです。実際、2016年11月に改定された大腸癌ガイドラインでも、投与推奨がされたのは二次治療におけるFOLFIRI療法との併用です。
以上のように、サイラムザ(ラムシルマブ)するの有効性のポテンシャルは高いですが、現在の保険医療下で使える状況ではアバスチン(ベバシズマブ)に勝るわけでもなく劣るわけでもありません。今後の臨床試験、治験によりサイラムザ(ラムシルマブ)の新たな可能性が発見されることは十分にあり得るので、時を待ちましょう。
サイラムザ(ラムシルマブ)の薬剤概要
製品名
サイラムザ
一般名
ラムシルマブ(ramucirumab)
用法用量
成人には2週間に1回ラムシルマブとして1回8mg/kg(体重)をおよそ60分かけて点滴静注する
効能効果
治癒切除不能な進行・再発の結腸・直腸癌
主な副作用
製造承認日
2015年6月(治癒切除不能な進行・再発の胃癌)
サイラムザ(ラムシルマブ)の作用機序
ロハス・メディカル
ラムシルマブはヒトVEGFR-2に対する特異的な抗体であり、VEGFリガンド(VEGF-A、VEGF-C、VEGF-D)のVEGFR-2への結合を阻害することで、VEGFR-2の活性化を阻害し、内皮細胞の増殖、遊走及び生存を阻害し、腫瘍血管新生を阻害します。
サイラムザ(ラムシルマブ)の最新情報
1)Ramucirumab versus placebo in combination with second-line FOLFIRI in patients with metastatic colorectal carcinoma that progressed during or after first-line therapy with bevacizumab, oxaliplatin, and a fluoropyrimidine (RAISE): a randomised, double-blind, multicentre, phase 3 study
概要
ステージ4大腸がん患者の二次治療としてFOLFIRI+>サイラムザ(ラムシルマブ)群とFOLFIRI+プラセボ群に分けて、その有効性を比較検討した試験。なお、前治療である一次治療にはFOLFOX+アバスチン(ベバシズマブ)が投与されている患者に対象は限定されている。
出典
The Lancet
配信日
2015年4月12日
サイラムザ(ラムシルマブ)の口コミ
医師のコメント
大腸癌2次治療ラムシルマブのRAISE試験サブ解析。日本人に引っ張られてるんだろうけど、サブ解析ではアジア人・非白人の成績が悪いなぁ。アジアでは非承認でいいんじゃないの…
/Ann Oncol https://t.co/RNtmWI2YhG— レ点 (@m0370) 2016年11月24日
大腸癌ガイドライン2016って、切除不能進行再発大腸癌の治療アルゴリズムのフローチャートには2次治療ラムシルマブも記載されてるのに、CQ16-2の2次治療分子標的薬のところでは全くラムシルマブは推奨度もエビデンスレベルも付かず黙殺されてるのか。
— レ点 (@m0370) 2016年11月24日
その他医療関係者のコメント
FDA Approves Ramucirumab for Second-Line Treatment of mCRC #cancer @CancerNetwrk http://t.co/WkN8LpB4QY
— UBM (@ubm) 2015年5月31日
サイラムザ点滴静注、メーカー主催のヒアリングやりましたけど微妙ですね・・・FOLFIRIと併用した試験で日本人のみ取り出したらOSをに有意差なかった→評価をPFSに切り替え&後治療で3レジメン以上やった患者を除外したら有意差が出たと→
— 山羊座のあきら (@akira_k1224) 2016年6月8日
すごく穿った見方をすれば何らかの理由で1stレジメンから切り替える際に、状態が悪い人ほどサイラムザを投与すればいいということになるのでは? 毎回尿検査とか煩雑だし使いドコロが難しいな・・
— 山羊座のあきら (@akira_k1224) 2016年6月8日
サイラムザ(ラムシルマブ)の治験情報
1)A Study in Second Line Metastatic Colorectal Cancer
治験の概要
ステージ4大腸がん患者の二次治療としてFOLFIRI+サイラムザ(ラムシルマブ)群とFOLFIRI+プラセボ群に分けてOS(全生存期間)を比較検討した試験。なお、前治療である一次治療にはFOLFOX+アバスチン(ベバシズマブ)が投与されている患者に対象は限定されている。
治験の期限
2012年2月
参照
1)日本イーライリリープレスリリース
2)大腸癌治療ガイドライン
この記事に利益相反はありません。


