11月6日、厚生労働省 薬事・食品衛生審議会医薬品第二部会は、「切除不能な進行・再発の非小細胞肺がん」適応にてアテゾリズマブ(商品名テセントリク)の新規製造販売承認、「再発又は難治性の古典的ホジキンリンパ腫」適応にてペムブロリズマブ(商品名キイトルーダ)の適応追加を了承した。
目次
非小細胞肺がん適応として初のPD-L1抗体
今回の了承のもとになったOAK試験の結果は、2016年10月7日から11日までデンマークのコペンハーゲンにて開催された欧州臨床腫瘍学会(ESMO2016)において公表されおり、2016年10月19日、アメリカ食品医薬品局(FDA)が「プラチナ製剤を含む化学療法に対して病態進行した転移性非小細胞肺がん(EGFR遺伝子変異、ALK遺伝子変異対象外)」の適応として承認した。
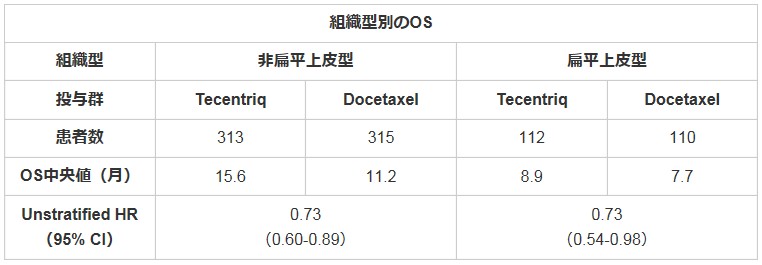
OAK試験は、プラチナ製剤含む化学療法を1回以上施行中または施行後に病勢が進行した非小細胞肺がん患者1,225名を対象として実施(二次治療および三次治療)。オープンラベルランダム化試験として、参加した患者は、3週間毎アテゾリズマブ1,200 mg静注する群(Tecentriq群)とドセタキセル(タキソテール)75 mg/m2静注する群(Docetaxel群)に1:1の割合で割り付けられた。扁平上皮癌(26%)および非扁平上皮癌(74%)の両組織型を対象とし、PD-L1の発現状況を問わずに登録された。
結果、PD-L1の発現状況に関わらない全集団において、アテゾリズマブ群の全生存期間(OS)中央値は13.8カ月であり、ドセタキセル(タキソール)と比べ4.2カ月の延長した(OS中央値:13.8カ月対9.6カ月;ハザード比0.73、95%Cl:0.62-0.87)。有害事象は、これまでに観察されたものと一致していた。
以下、中外製薬プレスリリース(2016年10月13日)を転載。
Tecentriq:テセントリク Docetaxel:ドセタキセル ITT:intention to treatの略であり、この試験結果の場合、参加された方のうち最初から順番に850名までの方 TC:腫瘍細胞のPD-L1発現 IC:腫瘍浸潤免疫細胞のPD-L1発現
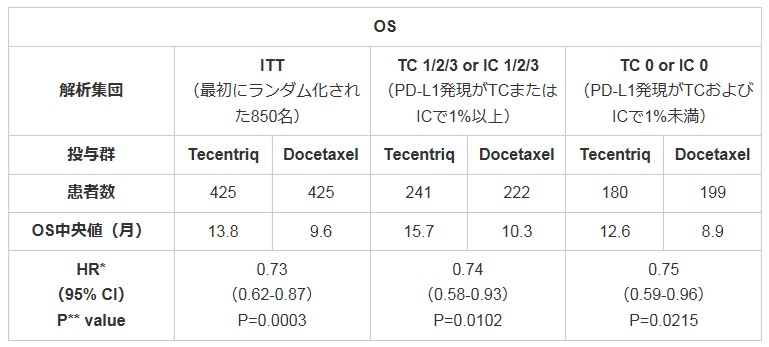
* TC 0およびIC 0のサブグループは無層別、その他は層別
** 層別log-rank検定
なお、非小細胞肺がんに対する免疫チェックポイント阻害薬としては、PD-1抗体のニボルマブ(オプジーボ)とペムブロリズマブ(キイトルーダ)が承認されているが、PD-L1抗体としては初の了承となる。
オプジーボとキイトルーダの過去の結果はどうであったか?
免疫チェックポイント阻害薬の比較は、以下の通り。※試験条件が異なるため参考値であることを注意
◆非小細胞肺がん(扁平上皮癌)の患者を対象とした第3相臨床試験(CheckMate-017)
・全生存期間の中央値:オプジーボ群が9.2 カ月、ドセタキセル群が6.0 カ月
◆非小細胞肺がん(非扁平上皮癌)の患者を対象とした第3相臨床試験(CheckMate-057)
・全生存期間の中央値:オプジーボ群が12.2 カ月、ドセタキセル群が9.4 カ月
切除不能な進行・再発非小細胞肺がん 免疫チェックポイント阻害薬オプジーボ 承認(オンコロニュース2015年12月17日)
◆非小細胞肺がんの患者を対象とした第3相試験(Keynote-010)※PD-L1発現している方のみ
・全生存期間の中央値:ペムブロリズマブ2mg/kg群、10.4か月、ペムブロリズマブ10mg/kg群:12.7か月、ドセタキセル群:8.5か月
非小細胞肺がん 免疫チェックポイント阻害薬PD-1抗体ペムブロリスマブ(キイトルーダ) 生存期間を延長 Lancet(オンコロニュース2016/1/11)
文:可知 健太
リサーチのお願い
この記事に利益相反はありません。