2017年12月7日、欧州臨床腫瘍学会免疫学シンポジウム(ESMO Immuno Oncology)にて、未治療の進行性非扁平上皮非小細胞肺がん患者に対するアテゾリズマブ(商品名テセントリク;以下テセントリク)+化学療法(カルボプラチン+パクリタキセル)+ベハジズマブ(商品名アバスチン;以下アバスチン)併用療法の有効性を検証した第III相のIMpower150試験(NCT02366143)の結果が発表されました。。
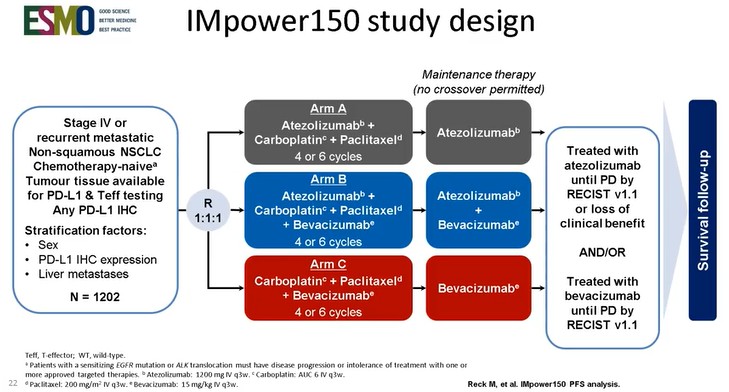
IMpower150試験とは、未治療の進行性非扁平上皮非小細胞肺がん患者(N=1202人)に対して以下の3群を1:1:1の割合で無作為に振り分け治療を行った。
・3週を1サイクルとして1日目にテセントリク1200mg+1日目に化学療法併用療法を4または6サイクル投与した後テセントリク単剤療法によるメンテナンス療法を投与する群(アームA)
・3週を1サイクルとして1日目にテセントリク1200mg+1日目に化学療法+1日目にアバスチン15mg/kg併用療法を4または6サイクル投与した後テセントリク+アバスチン併用療法によるメンテナンス療法を投与する群(アームB)
・3週を1サイクルとして1日目に化学療法+1日目にアバスチン15mg/kg併用療法を4または6サイクル投与した後アバスチン単剤療法によるメンテナンス療法を投与する群(アームC)
主要評価項目として無増悪生存期間(PFS)、全生存期間(OS)、副次評価項目として全奏効率(ORR)を比較検証した多施設共同オープンラベルの第III相試験である。
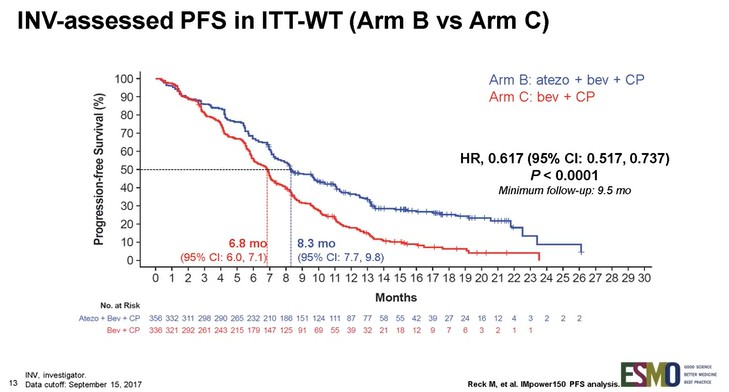
本試験の結果、主要評価項目である無増悪生存期間(PFS)中央値はテセントリク+化学療法+アバスチン併用療法群8.3カ月に対して化学療法+アバスチン併用療法群6.8カ月、病勢進行または死亡(PFS)のリスクをテセントリク+化学療法+アバスチン併用療法群で38%減少した(ハザード比:0.62、95%信頼区間:0.52-0.74、p<0.000)。また、ランドマーク解析による12カ月時無増悪生存(PFS)率は、テセントリク+化学療法+アバスチン併用療法群37%に対して化学療法+アバスチン併用療法群18%と、約2倍の差であった。
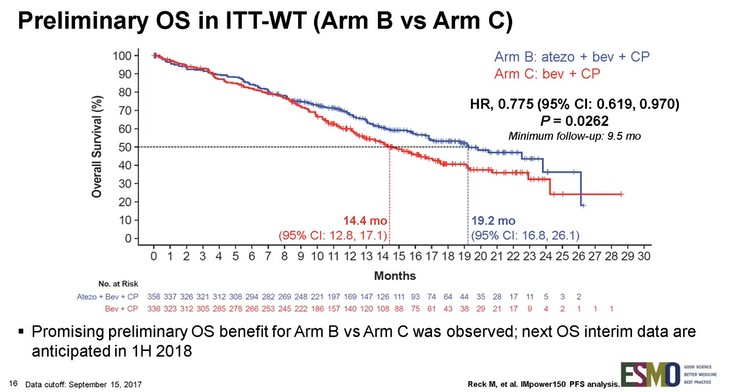
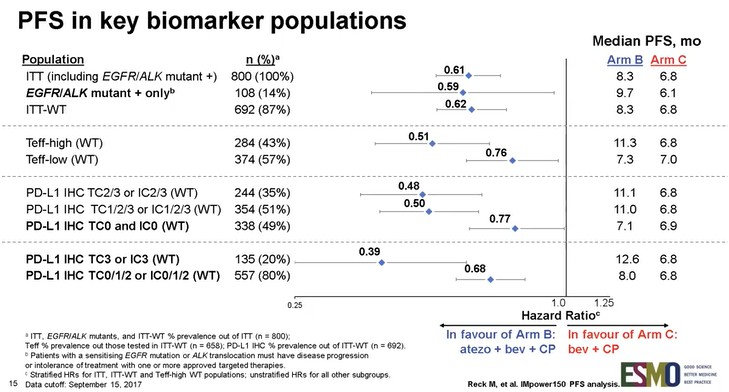
さらに、主要評価項目である無増悪生存(PFS)期間はALKまたはEGFR遺伝子変異陽性例を除いたITT解析集団、ならびにT細胞活性調整因子の遺伝子発現“Teff”により層別化した集団でも評価されており、両集団において化学療法+アバスチン併用療法群よりもテセントリク+化学療法+アバスチン併用療法群で統計学的有意な改善を示した。なお、アームAであるテセントリク+化学療法併用療法群に関する結果の公表については、2018年第1四半期を予定している。
また、副次評価項目である全奏効率(ORR)はテセントリク+化学療法+アバスチン併用療法群64%に対して化学療法+アバスチン併用療法群48%であった。
一方の安全性プロファイルとしては、各薬剤で認められている既存の安全性プロファイルと一致しており、テセントリク+化学療法+アバスチン併用療法レジメンにおける新たな安全性の懸念は確認されなかった。治療に関連した重篤な有害事象(AE)はテセントリク+化学療法+アバスチン併用療法群25.4%、化学療法+アバスチン併用療法群19.3%であった。
IMpower150試験の結果を受けて、エフ・ホフマン・ラ・ロシュ社・最高医学責任者兼国際開発責任者であるSandra Horning博士は以下のように述べている。「本試験は、様々は患者背景を有する進行性非扁平上皮非小細胞肺がん患者さんの一次治療として病勢進行(PFS)リスクを低下させた癌免疫療法初の第III相臨床試験です。」
ESMO Immuno Oncology 2017 Congress – Press Conferenceより、動画抜粋
LBA1_PR: Primary PFS and safety analyses of a randomized phase III study of carboplatin + paclitaxel +/− bevacizumab, with or without atezolizumab in 1L non-squamous metastatic NSCLC (IMpower150), Martin Reck
リサーチのお願い
この記事に利益相反はありません。


