※本記事はEvaluate社の許可のもと、オンコロが翻訳したものです。内容および解釈については英語の原文を優先します。正確な内容については原文をお読みください。
Impower-010試験は明らかに承認可能なエンドポイントの結果を出しているが、全被験者への効果は幻想であると研究者は考えている。
バーチャルの米国臨床腫瘍学会年次集会(ASCO 2021)で発表されたばかりのアジュバント療法の試験であるImpower-010試験のデータは、スイス・ロシュ社のテセントリク(一般名:アテゾリズマブ)が非小細胞肺がん(NSCLC)の周術期治療で承認される最初の免疫療法となる可能性を示唆している。
しかし、全被験者で認められた無病生存期間(DFS)の優位性は、明らかにPD-L1を発現している患者がもたらしたものであるという事実により、この勝利で得られるものは減りそうだ。Impower-010試験の筆頭著者である米スタンフォード大学医学部のHeather Wakelee博士は、「ベネフィットは…PD-L1が発現している患者にあり、発現していない患者にはないようだ」と述べている。
この結果は、詳細は機密情報扱いとなっているロシュ社の承認申請の戦略や同剤の市場規模を形成する。3月にImpower-010試験の結果がポジティブであると発表されたとき、スイスのグループは「これらのデータをできるだけ早く規制当局に提出する」と述べていた。
またこの結果には、患者のPD-L1陽性の問題以外にもさらなるニュアンスの違いがある。Impower-010試験ではアジュバント治療としてステージIB~IIIAのNSCLC患者を登録し、逐次解析を行っているが、当初はステージII~IIIA期の集団のみで、PD-L1が1%以上発現している患者を対象とし、その後、無作為化された全被験者を対象としたDFSの解析が行われた。
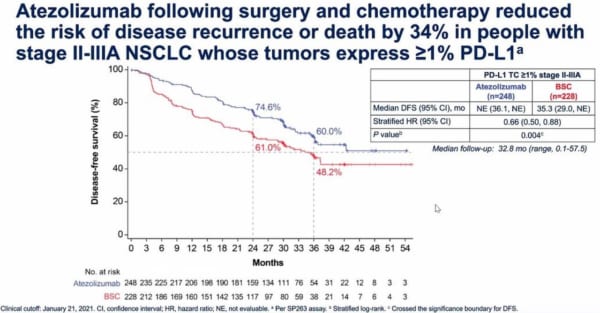
Impower-010試験のデータが正式に発表されるのに先立ち、Wakelee博士は今日(5月19日)行われた非公開のプレスコールで、ASCOのデータはこの2つの解析結果に関連するものだと説明した。また、PD-L1発現者における2年間のDFS率は、テセントリクが74.6%であったのに対し、ベストサポーティブケア(BSC)は61.0%だった。
中央値にはまだ達していないが、テセントリクによって疾患再発のリスクが全体で34%減少し、統計的に有意なp値だった。
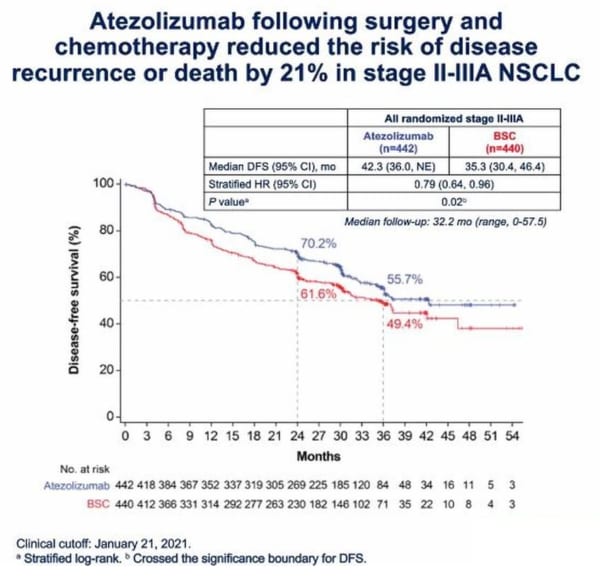
また、テセントリクは、ステージII~IIIAの集団において、PD-L1の発現にかかわらず21%の有効性を示し、これもp=0.02で統計学的有意性の境界を超えた。しかし、Wakelee博士は「ベネフィットの大部分は、腫瘍にPD-L1が発現していた患者にあるようだ」と述べている。
彼女は6月6日(日)のASCOでPD-L1陰性患者に特化した結果を発表する予定だが、ここではテセントリクとBSCの間でDFSに差がないことが強く示唆されている。
テセントリクがPD-L1発現者のみで承認された場合、患者のPD-L1状態を診断することは、治療に新たな負担を強いることになるが、遺伝子やバイオマーカーの分析は今や一般的である。ロシュ社にとってより重要なことは、市場規模がおよそ半分になる可能性があることだ。
また、ステージIBの集団が含まれるかどうかは別の問題である。Impower-010試験に参加した1005人のうち、ステージIBの患者は121人だけであり、一般的にこれらの患者は「より良い結果になる傾向がある」とWakelee博士は述べた。
Impower-010試験の次の層別解析では、ステージIB患者を含む全症例のDFSを調べ、続いて全症例の全生存期間(OS)を調べる予定である。現時点では、全症例の12カ月DFS率は71.4%対63.6%となっており、正式な解析を行うにはまだ十分ではない。
それでも、NSCLCのアジュバント療法の市場を一部でも獲得することができれば、テセントリクは抗PD-(L)1抗体の競合品よりも優位に立つことができる。アジュバント/ネオアジュバント療法の適応は、免疫療法にとって重要になってきており、今年はキイトルーダが腎がんで、オプジーボが膀胱がんのアジュバント療法でそれぞれ適応を取得している。
テセントリクは、トリプルネガティブ乳がん(TNBC)に対するネオアジュバント療法と尿路上皮がんに対するアジュバント療法で失敗した後、周術期のTNBCを対象としたImpassion-031試験において病理学的完全奏効で肯定的な結果を得たが、これは承認可能なエンドポイントではないと思われるため、成功を収めることは困難だった。
少なくとも、Impower-010試験におけるこのエンドポイントを使うことに問題はない。なぜならDFSは、昨年12月に英アストラゼネカ社のタグリッソ(一般名:オシメルチニブ)がEGFR陽性のNSCLCでアジュバント療法としての適応を取得した際の、まさにそのエンドポイントであったからだ。
この記事は、ステージII~IIIAの全被験者の分析結果が統計的に有意であったという事実を反映するように修正された。
■出典
Asco 2021 – adjuvant lung cancer beckons for Tecentriq, but only in PD-L1 expressers
肺がんの治験・臨床試験広告
【治験広告】非小細胞肺がん1A期の方を対象とした、PDT治験のご案内
2022.05.16
- 肺がん
- 臨床試験(治験)一覧
- 臨床試験(治験)広告一覧
【治験広告】分子標的薬が効きにくい EGFR陽性の非小細胞肺がんの方対象…
2022.04.01
- 肺がん
- 臨床試験(治験)一覧
- 臨床試験(治験)広告一覧
【治験広告】第1・2世代EGFR阻害薬の治療後に増悪した、T790M変異陰性の肺…
2020.10.01
- 肺がん
- 臨床試験(治験)一覧
- 臨床試験(治験)広告一覧