目次
進行卵巣がん患者を対象とした第3相PAOLA-1試験の詳細結果
2019年9月28日、英アストラゼネカ社(以下、アストラゼネカ)および米MSD社(米国およびカナダではMerck社、以下MSD)は、新たに診断された進行卵巣がん患者を対象とした第3相PAOLA-1試験において、オラパリブ(商品名:リムパーザ)(以下、リムパーザ)により無増悪生存期間(PFS)の統計学的に有意かつ臨床的に意義のある延長が認められたという良好な詳細結果を発表した。
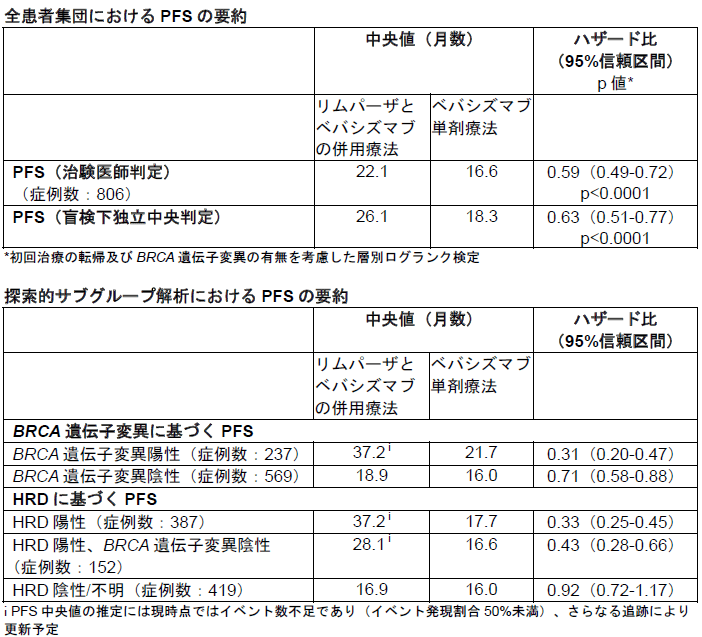
初回治療後の維持療法として実施された本試験では、患者の遺伝子変異等のバイオマーカーの状態および過去の手術の結果を問わず、リムパーザとベバシズマブの併用療法を標準治療であるベバシズマブ単剤療法と比較検討した。治験医師による評価に基づくPFSにおいて、リムパーザとベバシズマブの併用療法群では病勢進行または死亡のリスクが41%減少(ハザード比0.59に相当)し、PFS中央値はベバシズマブ単剤療法群が16.6ヶ月であったのに対し、リムパーザとベバシズマブの併用療法群で22.1ヶ月に延長された。また、試験開始から2年経過した時点において病勢進行が認められなかった患者の割合は、ベバシズマブ単剤療法群では28%であったのに対し、リムパーザとベバシズマブの併用療法群では46%であった。
盲検下独立中央判定(BICR)に基づいたPFSによる感度解析の結果は一貫しており、治験医師による評価に基づくPFSの結果と同様に、ベバシズマブ単剤療法群の中央値が18.3ヶ月であったのに対し、リムパーザとベバシズマブの併用療法群の中央値は26.1ヶ月に延長された。リムパーザとベバシズマブの併用療法群で認められた安全性および忍容性プロファイルはそれぞれの薬剤に関する既知のプロファイルと一致しており、QOL(生活の質)への悪影響は認められなかった。
また本試験では、BRCA遺伝子変異陽性(BRCAm)およびより広範な相同組換え修復異常(HRD)患者集団を含めた探索的なサブグループ解析も実施し、リムパーザとベバシズマブの併用療法がベバシズマブ単剤療法よりも、大きなベネフィットを示す結果が得られた。
BRCA遺伝子変異陽性のサブグループにおいて、リムパーザとベバシズマブの併用療法は病勢進行または死亡のリスクを69%減少した(ハザード比0.31に相当)。新たに進行卵巣がんと診断された患者の約半数が該当するBRCA遺伝子変異陽性を含めたより広範なHRD陽性のサブグループ(BRCAm患者を含む)においては、リムパーザとベバシズマブの併用療法は病勢進行または死亡のリスクを67%減少した(ハザード比0.33に相当)。
グレード3以上の有害事象(AE)の発現率は、リムパーザとベバシズマブの併用療法群において57%、ベバシズマブ単剤療法群においては51%であった。主な発現率20%以上のAEは悪心(53%)、疲労(53%)、高血圧(46%)、貧血(41%)、リンパ球減少(24%)、嘔吐(22%)および関節痛(22%)であった。グレード3以上のAEは高血圧(19%)、貧血(17%)、リンパ球減少(7%)、好中球減少 (6%)、疲労 (5%)、悪心(2%)、下痢 (2%)、白血球減少 (2%)嘔吐(1%)および腹痛(1%)であった。リムパーザの休薬に至ったAEの発現率は54%、投与中止に至ったAEの発現率は20%の結果だった。
本結果はスペインのバルセロナで開催された2019年欧州臨床腫瘍学会(ESMO)の年次総会プレジデンシャルシンポジウムにおいて発表された(抄録 #LBA2_PR)。
PAOLA-1試験とは
PAOLA-1試験は、新たにFIGO臨床進行期分類3-4期の高異型度漿液性または類内膜卵巣がん、卵管がんまたは腹膜がんと診断され、プラチナ製剤ベースの化学療法とベバシズマブによる1次治療により完全または部分奏効を示した患者を対象とし、初回治療後の維持療法としてリムパーザとベバシズマブの併用療法あるいは標準治療であるベバシズマブ単剤療法の有効性および安全性を比較検討した無作為化二重盲検第3相試験である。
PAOLA-1はGINECO(Groupe d’Investigateurs National des Etudes des Cancers Ovariens et du sein)を代表してARCAGY Research(Association de Recherche sur les CAncers dont GYnécologiques)により実施されたENGOT(European Network of Gynaecological Oncological Trial groups)の試験です。ACARGY-GINECOは患者のがんの臨床研究およびトランスレーショナルリサーチに特化した学究的な団体であり、GCIG(Gynecologic Cancer InterGroup:婦人科がんグループ)の会員。
卵巣がんとは
卵巣がんは全世界で、女性のがんによる8番目の死因。2018年には、約30万人が新たに診断され、約18万5,000人が死亡した1。大多数は進行(III期またはIV期)卵巣がんと診断され、5年生存率は約30%2。新たに進行卵巣がんと診断された患者にとって治療の最大の目的は、完全寛解または根治の達成を目指し、病勢の進行を出来る限り遅らせ生活の質を維持することである。3,4,5,6
相同組換え修復異常とは
相同組換え修復異常(HRDs)はBRCA遺伝子変異をはじめ、その他多くの遺伝子異常を含み、その異常は検査により診断が可能。BRCA遺伝子は相同組換えを介してDNAの修復を促進するため、本遺伝子の変異は相同組換えの修復異常の原因となり、正常細胞のDNA修復機構を妨ぐことができる。BRCA遺伝子変異は、新たに進行卵巣がんと診断された患者の半数近くに認められる多くの相同組換え修復異常のひとつの要因であり、リムパーザを含むPARP阻害剤に対する感受性をもたらす。
リムパーザとは
リムパーザは、ファーストインクラスのPARP阻害剤であり、BRCA1および/またはBRCA2遺伝子変異などの相同組換え修復の欠損を有する細胞または腫瘍のDNA損傷応答(DDR)を阻害する最初の標的治療薬。リムパーザによるPARP阻害はDNA一本鎖切断に結合するPARPを捕捉し、複製フォーク停止と崩壊を惹起することで、DNA二本鎖切断を起こしがん細胞を死滅させる。リムパーザはDDR経路に異常をきたした一連のPARP依存性の腫瘍タイプにおいて試験が進行中である。
リムパーザは、BRCA遺伝子変異の有無に関わらず、プラチナ感受性再発卵巣がんの維持療法として現在EU諸国を含む64ヶ国で承認されており、プラチナ製剤ベースの化学療法に奏効後のBRCA遺伝子変異陽性進行卵巣がんの初回治療後の維持療法としても米国、EU、日本およびその他数ヶ国において承認されている。また、本剤は化学療法による治療歴のある生殖細胞系列のBRCA遺伝子変異陽性かつHER2陰性の転移性乳がんの適応症でも米国、日本を含む43ヶ国において承認されており、EUにおいては、局所進行乳がんも含まれる。さらに、卵巣がん、乳がんおよび膵がんに関する薬事承認審査が他の国・地域において進行中。
アストラゼネカとMSDにより共同で開発、商業化が行われているリムパーザは進行卵巣がんおよび転移性乳がんの治療薬として承認され、現在までに全世界で2万5,000人を超える患者の治療に使用されている。リムパーザはPARP阻害剤として最も広範かつ最先端の臨床試験開発プログラムを有しており、アストラゼネカとMSDは複数のがん腫にわたって、リムパーザが単剤療法および併用療法としてPARP依存性腫瘍に及ぼす影響を解明するため一致協力している。リムパーザはがん細胞のDDRメカニズムを標的とする新薬候補のアストラゼネカの業界を主導するポートフォリオの基盤となる化合物である。
GINECOとは
GINECO(Groupe d’Investigateurs National pour l’Etude des Cancers de l’Ovaire et du sein)は国および国際的なレベルで婦人科疾患および進行乳がん臨床試験を企画・実施する、フランス国立がんセンター(INCA)によって命名されたフランスのがん研究協力団体。1993年に設立されたGINECOグループは、ENGOTおよびGCIGなどの国際的コンソーシアムの会員である。
ENGOTとは
ENGOT(European Network for Gynaecological Oncological Trial groups)はESGO(欧州婦人科腫瘍学会)の研究ネットワーク。2007年に創設されたENGOTは現在欧州25ヶ国の21の協力団体により構成されている。
GCIGとは
The GCIG(Gynecological Cancer InterGroup)は婦人科がん患者の転帰を改善するために品質の高い臨床試験の推進および円滑な実施を目指している。1998年創設されたGCIGは世界28ヶ国の23の協力団体により構成されている。
出典
1.The World Health Organization. IARC. Globocan 2018.[Accessed August 2019].
2.National Cancer Institute. (2019). Cancer Stat Facts: Ovarian Cancer [Accessed August 2019].
3.Moore K et al. Maintenance Olaparib in Patients with Newly Diagnosed Advanced Ovarian Cancer. Presented at ESMO October 2018.
4.Raja, F. A., Chopra, N. & Ledermann, J. A. 2012. Optimal first-line treatment in ovarian cancer. Ann. Oncol. Off. J. Eur. Soc. Med. Oncol. 23 Suppl 10, x118-127.
5.NHS Choices, Ovarian Cancer[Accessed August 2019].
6.Ledermann.et al. 2013. Newly diagnosed and relapsed epithelial ovarian carcinoma: ESMO Clinical Practice for diagnosis, treatment and follow-up. Annals of Oncology, 24(suppl 6), pp.vi24-vi32.
参照元:
2019年10月4日発行アストラゼネカ株式会社プレスルーム
この記事に利益相反はありません。