目次
白金製剤を用いた1レジメンの化学療法を含む最低2レジメンの全身療法による治療歴を有する、既知のEGFR TK活性化変異及びALK再配列を有さない局所進行又は転移性非小細胞肺癌患者(ステージIIIB-IV)を対象とした、PD-L1発現に応じた単独療法又はtremelimumabとの併用療法としてのMEDI4736と標準的治療を比較する国際多施設共同第3相無作為化非盲検試験(ARCTIC)
| 対象がん腫 | 非小細胞肺がん |
| フェーズ | P3 |
| 実施期間 | 2015年1月~2017年2月 |
| 実施国 | 日本、 米国、アルゼンチン、オーストラリア、ベルギー、ブルガリア、カナダ、チリ、チェコ、フランス、ドイツ、ギリシャ、香港、ハンガリー、イスラエル、イタリア、韓国、オランダ、フィリピン、ポーランド、ルーマニア、ロシア、セルビア、シンガポール、南アフリカ、スペイン、台湾、タイ、トルコ、イギリス |
| 目標症例 | 900 |
| 状況 | 募集中 |
| 手法 | ランダム化、オープンラベル |
| 被験薬名 | MEDI4736 (一般名:デュルバルマブ、 商品名:-----)、CP-675,206(一般名:トレメリムマブ、 商品名:-----) |
| 種類 | 免疫チェックポイント阻害薬複合療法(抗PD-L1抗体と抗CTLA-4抗体) |
| 投与経路 | 静脈内投与 |
試験概要
<専門的な説明>
本試験は、PD-L1陽性腫瘍を有するNSCLC患者においてMEDI4736単独投与の有効性及び安全性を標準的治療と比較評価し、PD-L1陰性腫瘍を有するNSCLC患者においてMEDI4736 + tremelimumab 併用投与の有効性及び安全性を標準的治療と比較評価する第3相多施設共同無作為化非盲検試験である。本治験には、白金製剤を用いた1レジメンの化学療法を含む最低2レジメンの全身療法によるNSCLC治療歴を有する局所進行又は転移性NSCLC患者(ステージIIIB-IV)の男女を組み入れる。上皮成長因子受容体(EGFR)チロシンキナーゼ(TK)活性化変異及び未分化リンパ腫キナーゼ(ALK)再配列を有することが既知の患者は本治験に不適格である(本治験では、プロスペクティブな検査は予定していない)。標準的治療:エルロチニブ、ゲムシタビン又はビノレルビン。
<一般的な説明>
非小細胞肺がん患者で、PD-L1陽性の方に対しては、MEDI4736(デュルバルマブ)の単独投与と標準治療のどちらかを投与して有効性と安全性を比較。PD-L1陰性の方に対しては、MEDI4736とトレメリムマブの併用投与と標準治療のどちらかを投与して有効性と安全性を比較する臨床試験です。
対象者は、プラチナ製剤(パラプラチンやブリプラチンなど)を用いた1種類の化学療法を含む最低2種類以上の全身療法による非小細胞肺がんの治療を受けたことのある、局所進行または転移性の非小細胞肺がん患者(ステージ3b~4)の男女です。また、本試験では、EGFRチロシンキナーゼ活性化変異およびALK再配列をもつことが既知の方は参加できません(但し、今回はそのための特別な検査は行いません)。標準治療薬には、エルロチニブ、ゲムシタビンまたはビノレルビンを用います。
治験薬剤の説明
<専門的な説明>
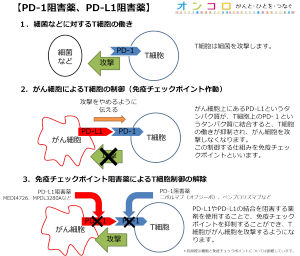
Durvalumabは、プログラム細胞死リガンド1(PD-L1)に対する、開発中ヒトモノクローナル抗体です。PD-L1を介するシグナルにより、腫瘍は免疫システムから探知されるのを回避していますが、durvalumabはこれらのシグナルを阻害することで、腫瘍の免疫からの逃避機構が働かないよう作用します。Durvalumabは、他の免疫治療薬と並行して、患者さんの免疫システムを活性化し、がんを攻撃するように開発されています。Durvalumabは広範な臨床試験プログラムにおいて、単剤療法もしくはtremelimumabとの併用で、NSCLC、頭頸部がん、胃がん、膵臓がん、膀胱がんおよび血液がんにおいて検討されています。
アストラゼネカプレスリリース(20150921)参照
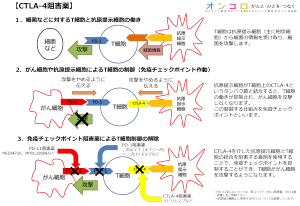
Tremelimumabは、ヒトの自己免疫システムを活性化するよう設計され、開発されています。本剤は完全ヒトモノクローナル抗体で、活性化Tリンパ球の表面に発現するタンパクCTLA-4に結合することで、がん細胞を攻撃するよう免疫システムを活性化します。
アストラゼネカプレスリリース(20150417)参照
<一般的な説明>
通常、細菌等の異物が体内に認められたときに免疫細胞が攻撃します。一方、がん細胞は免疫細胞から異物と認められないような機能を有しますが、その時にPD-L1というタンパク質がかかわっています。MEDI4736(デュルバルマブ)やトレメリムマブはその機能を無効にできると期待されており、その結果、がん細胞を異物であると認識することができるようになります。がん細胞を異物と認識できるようになると、免疫細胞ががん細胞を攻撃できるようになります。
主な参加条件等
この試験の対象となりうる方
- 18歳以上の方
- ステージ3bまたはステージ4の非小細胞肺がんと診断された方
- プラチナ製剤を用いた化学療法受けた方が、この他に1種類以上の全身療法を受けて、進行または再発が見られた方
- ECOG PSが0~1の方
この試験の対象とならない方
- 過去に抗PD-1抗体や抗PD-L1抗体を使用されたことがある方
- 脳にがんの転移が認められた方
- 現在または過去2年間に自己免疫疾患の既往歴がある方
- コントロール不良な全身性疾患を有する方
- 化学放射線療法によるCTCAEグレード3以上の副作用から回復していない患者。(CTCAEグレード3以上⇒中等度~重度の副作用)
- EGFRまたはALK遺伝子変異が認められた方
- 過去の免疫療法薬の投与中に生じたグレード3以上の免疫に関する有害事象またはグレード2以上の免疫に関連した有害事象が回復していない方
臨床試験公開情報
JAPIC No : JapicCTI-152828
最終更新日:2015/3/2
ClinicalTrials.gov Identifier:NCT02352948
最終更新日:2016/1/11
治験詳細を見る
【JapicCTI】
http://www.clinicaltrials.jp/user/search/directCteDetail.jsp?clinicalTrialId=12951
【Clinical Trials. gov】
https://clinicaltrials.gov/ct2/show/NCT02352948?
注意
・試験タイトルに英語記載がある場合、JAPIC等の日本語公開情報に掲載がないことを意味します。
・試験概要の「専門的な説明」は、JAPICやUMINに情報がある場合はそこから、ない場合はClinidcaltrials.govから転記しています。
・薬剤の「専門的な説明」は、開発企業に情報がある場合はそこから、ない場合はNCI(National Cancer Institute)から転記しています。
・専門的な記載を一般の方がわかるよう記載していますが、当社の認識が誤っていることがありますので、必ず実際の公開情報を確かめてください。
・実施医療機関は明記できませんが、実際の公開情報に明記されている場合があります。
・主な参加条件には記載された基準以外にも多くの基準があります。
初回作成:川村 千恵 (最終改訂:可知 健太)


